
Рефераты по рекламе
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Рефераты по строительным наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Рефераты по сексологии
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Реферат: Химико-токсикологический анализ лекарственных средств, производных фенотиазина
Реферат: Химико-токсикологический анализ лекарственных средств, производных фенотиазина
Министерство здравоохранения и социального развития РФ ДВГМУ
Кафедра органической и токсикологической химии
Реферат
Химико-токсикологический анализ лекарственных средств, производных фенотиазина
Выполнил: студент Барахова В.С.
Проверил преподаватель: Якушева Н.Ю.
Хабаровск 2010
Оглавление
Введение
1. Токсикологическое значение и метаболизм
2. Изолирование производных фенотиазина из биологического материала
3. Качественное обнаружение производных фенотиазина в экстракте
4. Количественное определение производных фенотиазина и их метаболитов
Список используемой литературы
В России и за рубежом, начиная с 1945 г., после обнаружения фармакологической активности N-замещенных производных фенотиазина, было синтезировано большое число препаратов, обладающих нейролептическим, противогистаминным, холинолитическим, седативным, антиаритмическим и коронарорасширяющим действием.
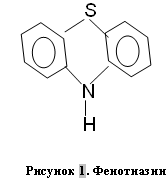
В основе химической структуры данной группы препаратов лежит гетероциклическая система, состоящая из шестичленного гетероциклатиазина, конденсированного с двумя ядрами бензола (рис. 1).
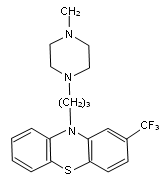
2-Трифторметил-10- [3-(1-метилпиперазинил-4)-пропил] -фенотиазина дигидрохлорид.
(По химическому строению трифтазин отличается от хлорпромазина тем, что вместо атома хлора в положении 2 фенотиазинового ядра содержит группу СF3, а в боковой цепи — ядро пиперазина, замещённое при атоме азота в положении 4 группой СН3, как у метеразина).
Препараты, производные фенотиазина, представляют собой сходные по химической структуре соединения, отличающиеся только заместителями в положении 2 и 10 фенотиазинового кольца, причем между структурой заместителей и фармакологическим действием проявляется четкая зависимость: если в 10 положении находится липофильная группировка, содержащая третичный азот во 2’ или 3’ положении, то препарат оказывает нейролептическое, седативное и противоаллергическое действие. Если же эта группировка гидрофильная (карбоксильная группа), то препарат оказывает коронарорасширяющее и антиаритмическое действие.
1. Токсикологическое значение и метаболизм
При приеме внутрь всасывается не полностью. Cmax достигается через 2-4 ч, при в/м введении - через 1-2 ч. В плазме связывается с белками на 99%. Проникает через ГЭБ. Метаболизируется в печени. T1/2 составляет 15-30 ч. Экскретируется почками в основном в виде метаболитов. Токсическая концентрация в крови - 1-2 мг/л, смертельная - 3-12 мг/л.
Препараты фенотиазинового ряда, так же как и другие психотропные, антигистаминные и сердечно-сосудистые средства, кроме собственно терапевтического эффекта, проявляют побочное и токсическое действие. Введение их в организм в дозах, превышающих терапевтические (медицинские ошибки, бытовые и суицидальные отравления), нередко приводит к летальным исходам. Описано большое количество отравлений этими соединениями, нередко в сочетании с другими лекарственными препаратами (барбитуратами, производными изоникотиновой кислоты, имизином, антибиотиками, инсулином и др.).
Производные фенотиазина обладают кумулятивными свойствами и длительно выводятся из организма. Например, терапевтическая доза аминазина (50 мг) выводится из организма в течение 14-20 дней. Смертельные случаи могут наблюдаться при приемах обычных терапевтических доз.
Клиника течения отравлений производными фенотиазина во многом зависит от возраста, пола, дозы принятого лекарства и не является характерной и специфичной. Нехарактерна также и патологоанатомическая картина. Химическое исследование крови и мочи больных, а также внутренних органов и биологических жидкостей погибших могут оказать существенную помощь в диагностике отравления.
Биотрансформация производных фенотиазина идет по основным типам метаболизма; сульфоокисление, деметилирование, образование N-оксида, гидроксилирование и т. д. Главным метаболитом, общим для всех производных фенотиазина, является сульфоксид (рис. 2).
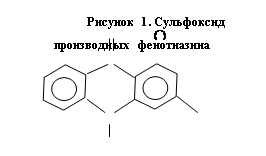 |
Объектами исследования на производные фенотиазинового ряда являются желудок и кишечник с содержимым, печень, легкие, почки, кровь и моча.
В трупном материале производные фенотиазина и их метаболиты сохраняются (при температуре от –20 до +130С) до 3 месяцев. Консервирование материала этиловым спиртом увеличивает сохраняемость производных фенотиазина в трупном материале.
2. Изолирование производных фенотиазина из биологического
материала
По физико-химическим свойствам препараты, производные фенотиазина, представляют собой белые кристаллические порошки, растворимые или слаборастворимые в воде, хорошо растворимые в этиловом спирте (в виде солей), диэтиловом эфире и хлороформе (в виде оснований).
Изолирование аминазина, дипразина и их метаболитов рекомендуется производить спиртом, подкисленным до рН 2,0-3,0 10% раствором щавелевой кислоты, с последующей экстракцией основания эфиром при рН 13,0 и реэкстракцией вещества в 0,5 н раствор серной кислоты (изолирование по Е.М. Саломатину).
Также изолирование производных фенотиазина можно проводить путем экстракции из биологического материала подкисленной водой, с последующей экстракцией органическим растворителем (диэтиловый эфир, хлороформ) из этого раствора, подщелоченного с помощью 25% раствора аммиака.
Методы пробоподготовки мочи для определения трифтазина
1) так как производные фенотиазинов выводятся в виде глюкуронидов, то требуется гидролиз мочи (нагревают пробу в течение 30 минут с концентрированной соляной кислотой).
2) затем экстрагируют смесью гептан-3% изопентанол для ГЖХ; бензол-диоксан-25% аммиак (60:35:5) или этилацетат-ацетон-25% аммиак в этаноле 1:1 (50:45:4) для ТСХ.
3. Качественное обнаружение производных фенотиазина в экстракте
С растворами йодида висмута в йодиде калия и фосфорно-молибденовой кислоты производные фенотиазина дают аморфные осадки
С концентрированной серной кислотой возникает устойчивое пурпурно-красное окрашивание
С формалином и серной кислотой производные фенотиазина дают пурпурно-красное окрашивание, усиливающееся при стоянии
С концентрированной азотной кислотой возникает пурпурно-красное окрашивание (образование сульфоксида), которое быстро исчезает (образование сульфона)
С 5% раствором золотохлористо-водородной кислоты аминазин (после 3-4 кратной обработки основания 0,1 н. раствором HCl) выделяется темно-красный аморфный осадок, переходящий через 20-50 мин. в характерный кристаллический осадок. Кристаллы в виде палочек и сростков из них, напоминают снопы и сфероиды. Кристаллы оптически активны (погасание косое, угол погасания 20-300, удлинение кристаллов положительное).
С реактивами Марки и Фреде тизерцин дает синевато-красную окраску; окраска у других производных фенотиазина — от красной до фиолетовой.
С реактивом Манделина тизерцин дает красно-фиолетовую окраску; дипразин дает зеленую, переходящую в пурпурную окраску. Окраска у других производных фенотиазина — от красной до фиолетовой.
Предварительные хромогенные реакции, используя реактив Марки – красно-коричневый цвет.
2) для экспресс-определения фенотиазинов в моче используют реакцию с FNP-реактивом, который состоит из смеси водного раствора хлорида железа (III), хлорной кислоты (HClO4) и азотной кислоты (1:9:10). Появляющаяся окраска от розовой до сине-фиолетовой свидетельствует о присутствии фенотиазинов или их метаболитов. Определению мешают салицилаты, желчные пигменты и пр.
Более надежный способ обнаружения производных фенотиазина в экстракте, а тем более для различения веществ друг от друга — обнаружение и разделение веществ с помощью хроматографии. Для этого на хроматографическую пластинку наносят каплю исследуемого раствора. Нанесенное пятно подсушивают на воздухе. Рядом наносят растворы известных препаратов, производных фенотиазина («свидетели») и вновь подсушивают пластинку. Затем пластинку вносят в камеру для хроматографии, насыщенную парами растворителя (смесь 25% раствора аммиака и этилового спирта в соотношении 1:1, либо 25% раствора аммиака, этилацетата и ацетона 4:90:45). После хроматографирования пластинку проявляют 50% раствором серной кислоты в этиловом спирте. Затем пластинку помещают на 3-5 мин в сушильный шкаф, нагретый до 1000С. Проявившееся пятна сравнивают с пятнами «свидетелей» или по справочным значениям Rf.
Обнаружить производные фенотиазина можно также по УФ - и ИК-спектрам. Например, раствор тизерцина в этиловом спирте имеет максимумы поглощения при длине волны 255 и 310 нм, а аминазин при 254-255 нм. Основной метаболит — сульфоксидное производное фенотиазина имеет максимумы поглощения при длине волны 238-240, 273, 298 и 340 нм. Тизерцин в растворе 0,1 н. соляной кислоты имеет максимум в области 251 и 302 нм. Дипразин, растворенный в 0,01 н. растворе соляной кислоты, имеет максимумы поглощения при 249 и 300 нм; растворенный в смеси воды и этилового спирта (1:1) — 252 и 301 нм. В ИК-области спектра основание тизерцина (диск с бромидом калия) имеет основные пики при 1587, 1460, 1269 и 1446 см-1; дипразин имеет пики при 1459, 1222 и 757 см-1.
4. Количественное определение производных фенотиазина и их
метаболитов
Фотоколориметрический метод определения основан на реакции с концентрированной серной кислотой. Фотометрирование проводят при λ=508 нм в кювете 5,105; эталон сравнения — контроль реактивов. Расчет содержания препаратов производится по калибровочному графику.
Спектрофотометрический метод основан на количественной оценке поглощения растворов препаратов в ультрафиолетовой области. Ультрафиолетовый спектр снимается в диапазоне длин волн 220-400 нм на СФ-4, СФ-4а и др. при концентрации 10 мкг/мл в пересчете на основание.
По этим методикам обнаруживается 53-60% препарата, добавленного к органам. Граница обнаружения 0,2 мг, граница определения 0,5 мг препарата в 100 г органах.
фенотиазин метаболизм производные
Список используемой литературы:
1. Гуськова Т.А. Токсикология лекарственных средств. – М., 2003.
2. Карпов Ю.А., Савостин А.П. Методы пробоотбора и пробоподготовки. – М., 2003.
3. Крамаренко В.Ф. Токсикологическая химия. – М., 1989.
4. Токсикологическая химия / под ред. Т.В.Плетеневой. – М.: Изд.группа «ГЭОТАР-Медиа», 2006.
5. Химико-фармацевтический журнал, № 4 , 2003, стр.22-24.