
Рефераты по рекламе
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Рефераты по строительным наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Рефераты по сексологии
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Реферат: Производство серной кислоты
Реферат: Производство серной кислоты
Серная кислота – один из основных много тоннажных продуктов химической промышленности. Ее применяют в различных отраслях народного хозяйства, поскольку она обладает комплексом особых свойств, облегчающих ее технологическое использование. Серная кислота не дымит, не имеет цвета, запаха, при обычной температуре находится в жидком состоянии. В концентрированном виде не корродирует черные металлы. В то же время серная кислота относится к числу сильных минеральных кислот, образует многочисленные устойчивые соли и дешева.
Высокая активность серной кислоты в сочетании со сравнительно небольшой стоимостью производства предопределило большие масштабы и чрезвычайное разнообразие ее применения. Среди минеральных кислот серная кислота по объему производства и потребления занимает первое место. Мировое производство ее составляет более 160 млн. т. в год. Области применения серной кислоты и олеума весьма разнообразны. Значительная часть ее используется в производстве минеральных удобрений (от 30 до 60 %), многие кислоты (фосфорная, уксусная, соляная) и соли производятся в значительной части при помощи серной кислоты. Серная кислота широко применяется в производстве цветных и редких металлов, а также в производстве красителей (от 2 до 16 %), химических волокон (от 5 до 15 %) и металлургии (от 2 до 3 %). Она применяется для различных технологических целей в текстильной, пищевой и других. На рисунке представлены области применения серной кислоты и олеума.
Безводная серная кислота (моногидрат) Н2SО4 представляет собой тяжелую маслянистую жидкость, которая смешивается с водой во всех соотношениях с выделением большого количества тепла. Плотность серной кислоты при 00С равна 1.85 г./см3. Она кипит при Т = 2960С и замерзает при -100С. Серной кислотой называют не только моногидрат, но и водные растворы его (Н2SО4 + nН2О), а также растворы серного ангидрида в моногидрате (Н2БО4 + пБО3), называемые олеумом. Олеум на воздухе «дымит» вследствие десорбции из него БО3. Чистая серная кислота бесцветна, техническая окрашена примесями в черный цвет.
Н2SО4 *(n‑1) SО3 ← Н2SО4 → Н2SО4 * (m -1) Н2О
Олеум моногидрат водная кислота
При m = n =1 это моногидрат, при m >n – водные растворы, при m<n – растворы оксида серы в моногидрате. При смешении с водой образуются гидраты состава Н2SО4* nН2О; Н2SО4* 2Н2О; Н2SО4* 4Н2О и соединения с оксидом серы Н2SО4*SО3 и SО4* 2SО3.
Эти гидраты и соединения с оксидом серы имеют различные температуры кристаллизации и образуют ряд эвтектик. Некоторые из этих эвтектик имеют температуру кристаллизации ниже нуля или близкие к нулю. Эти особенности растворов серной кислоты учитываются при выборе ее товарных сортов, которые по условиям производства и хранения должны иметь низкую температуру кристаллизации. Для транспортировки, применения серной кислоты большое значение имеет изменение температуры плавления и температуры ее кипения в зависимости от концентрации. При возрастании концентрации от 0% Н2SО4 до 64.35 % SО3 (своб) последовательно образуется шесть гидратов, являющихся индивидуальными химическими соединениями, которые взаимно нерастворимы в твердом виде. В области концентраций SО3 от 64.36 % до 100 % при кристаллизации образуются твердые растворы. В зимнее время при низких температурах нельзя производить и применять кислоту с концентрацией, близкой к чистому SО3; 2SО3 * Н2О; SО3 *Н2О, так как из этих растворов могут выпадать кристаллы, которые забьют кислотопроводы между цехами, хранилища, насосы.
Пары серной кислоты при повышении температуры диссоциируют
Н2SО4→ Н2О +SО3
и при температурах выше 4000С уже содержат больше молекул SО3, чем Н2SО4
2Н2SО4 ↔2Н2О + 2 SО3 ↔2SО3 + 2 Н2О +О2
4000С 7000
Серная кислота весьма активна. Она растворяет оксиды металлов и большинство металлов; вытесняет при повышенной температуре все другие кислоты из солей. Она отнимает воду от других кислот, от кристаллогидратов солей. Дерево и другие растительные и животные ткани, содержащие целлюлозу, крахмал и сахар, разрушаются под действием концентрированной серной кислоты, вода связывается с кислотой и от ткани остается лишь мелкодисперсный углерод. В разбавленной кислоте целлюлоза и крахмал распадаются с образованием сахаров. При попадании на кожу человека концентрированная серная кислота вызывает ожоги.
Еще в 13 веке серную кислоту получали термическим разложением железного купороса FеSО4, поэтому и сейчас один из сортов серной кислоты называют купоросным маслом, хотя давно уже серная кислота не производится из купороса. Ныне серная кислота производится двумя способами: нитрозным, существующим более 200 лет, и контактным, освоенным в промышленности в конце 19 и начале 20 века. Контактный способ вытесняет нитрозный (башенный).
Первой стадией сернокислотного производства по любому методу является получение сернистого газа при сжигании сернистого сырья. После очистки сернистого газа (особенно в контактном способе) его окисляют до серного ангидрида, который, соединяясь с водой, образует серную кислоту. Окисление SО2 в SО3 протекает крайне медленно. Для ускорения процесса применяют катализаторы.
В контактном методе окисление сернистого ангидрида в серный осуществляется на твердых контактных массах. Благодаря усовершенствованию контактного способа производства себестоимость более чистой и высококонцентрированной серной кислоты лишь незначительно выше, чем башенной. В н.в. около 80 % всей кислоты производится контактным способом.
В нитрозном способе катализатором служат оксиды азота. Окисление БО2 происходит, в основном, в жидкой фазе и осуществляется в башнях с насадкой. Поэтому нитрозный способ по аппаратурному признаку называют башенным. Сущность башенного способа заключается в том, что полученный при сжигании сернистого сырья сернистый газ, содержащий примерно 9% SО2 и 9-10% О2, очищается от пыли и поступает в башенную систему, состоящую из нескольких башен с насадкой. В башнях протекает ряд абсорбционно-десорбционных процессов, осложненных химическими превращениями. В первых двух-трех башнях насадка орошается нитрозой, в которой растворенные оксиды азота химически связаны в виде нитрозилсерной кислоты КОНSО4. В последующих трех – четырех башнях десорбированные в газовую фазу в результате реакции окислы азота поглощаются серной кислотой, образуя вновь нитрозилсерную кислоту. Таким образом, окислы азота совершают кругооборот и теоретически не должны расходоваться. Нитрозным способом получают загрязненную примесями и разбавленную 70–75 % серную кислоту, которая используется в основном в производстве минеральных удобрений.
Сырьем в производстве серной кислоты могут быть элементарная сера и различные серосодержащие соединения, из которых могут быть получена сера или непосредственно оксид серы.
Природные залежи самородной серы невелики. Чаще всего сера находится в природе в форме сульфидов и сульфатов металлов, а также входит в состав нефти, каменного угля, природного газа. Значительные количества серы содержатся в виде оксида серы в топочных газах и газах цветной металлургии и в виде сероводорода, выделяющегося при очистке горючих газов. Таким образом, сырьевые источники производства серной кислоты достаточно многообразны, хотя до сих пор в качестве сырья используют преимущественно элементарную серу и железный колчедан. Ограниченное использование таких видов сырья, как топочные газы ТЭС и газы медеплавильного производства, объясняется низкой концентрацией в них оксида серы (4). При этом доля колчедана в балансе сырья уменьшается, а доля серы возрастает.
В общей схеме сернокислотного производства существенное значение имеют две первые стадии – подготовка сырья и его сжигание или обжиг. Их содержание и аппаратурное оформление существенно зависят от природы сырья, которая в значительной степени, определяет сложность технологического производства серной кислоты.
1. Железный колчедан.
Природный железный колчедан представляет сложную породу, состоящую из сульфида железа РеБ2, сульфидов других металлов (меди, цинка, свинца и др.), карбонатов металлов и пустой породы. В РФ залежи колчедана имеются на Урале и Кавказе, где его добывают в рудниках в виде рядового колчедана. Процесс подготовки рядового колчедана к производству ставит целью извлечение из него ценных цветных металлов и повышение концентрации дисульфида железа.
Чистый пирит содержит 53.5% серы и 46.5% железа. В серном колчедане содержание серы обычно колеблется от 35 до 50%, железа от 30 до 40%, остальное составляют сульфиды цветных металлов, углекислые соли, песок, глина и др.
Схема подготовки рядового колчедана представлена на рисунке.
кислота серный сырье химический
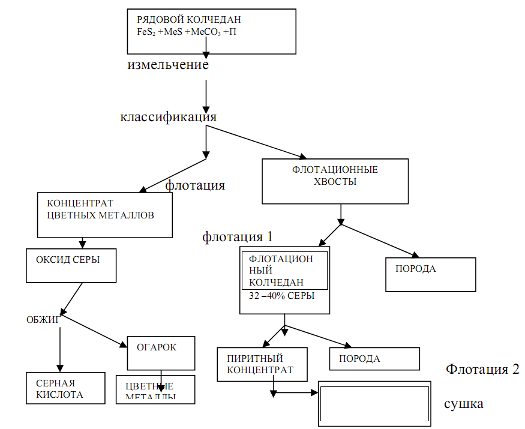
На основе материального баланса рассчитываются расходные коэффициенты, определяются размеры аппаратов и устанавливаются оптимальные значения параметров технологического режима процесса.
2. Сера.
Элементарная сера может быть получена из серных руд или газов содержащих сероводород или оксид серы. В соответствии с этим различают серу самородную и серу газовую комовую:
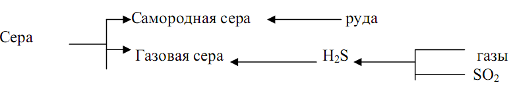
На территории РФ залежей самородной серы практически нет. Источником газовой серы являются Астраханское газоконденсатное месторождение, Оренбургское и Самарское месторождения попутного газа.
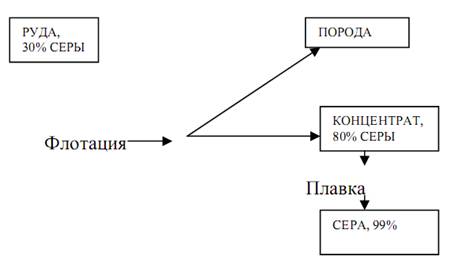
Из самородных руд серу выплавляют в печах, автоклавах или непосредственно в подземных залежах (метод Фраша). Для этого серу расплавляют непосредственно под землей, нагнетая в скважину перегретую воду, и выдавливают расплавленную серу на поверхность сжатым воздухом.
Схема подготовки самородной серы
Получение газовой серы из сероводорода, извлекаемого при очистке горючих и технологических газов, основано на процессе неполного его окисления над твердым катализатором. При этом протекают реакции:
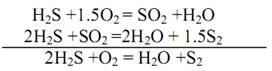
3. Сероводород.
Источником сероводорода служат различные горючие газы: коксовый, генераторный, попутный, газы нефтепереработки. Извлекаемый при их очистке газ, содержит до 90 % сероводорода и не нуждается в специальной подготовке.
Доля сырья в себестоимости продукции сернокислотного производства достаточно велика. Поэтому технико-экономические показатели этого производства существенно зависят от вида используемого сырья. В таблице приведены основные ТЭП производства серной кислоты из различного сырья (за 100 % взяты показатели производства на основе железного колчедана).
| Сырье | ||||
| показатели | Железный колчедан | Самородная сера | Газовая сера | Сероводород |
| Удельные капиталовложения в производство | 100 | 57 | 57 | 63 |
| Себестоимость кислоты | 100 | 125 | 67 | 80 |
| Приведенные затраты | 100 | 118 | 75 | 72 |
Замена колчедана серой приводит к снижению капитальных затрат на строительство и улучшению экологической обстановки в результате ликвидации отвалов огарка и уменьшению выбросов токсичных веществ в атмосферу. Вследствие сложностей с транспортом серной кислоты сернокислотные заводы располагаются преимущественно в районах ее потребления.
Поэтому производства серной кислоты развито во всех экономических районах РФ. Важнейшими центрами его являются: Щелково, Новомосковск, Воскресенск, Держинск, Березняки, Пермь.
Производство серной кислоты из серусодержащего сырья включает несколько химических процессов, в которых происходит изменение степени окисления сырья и промежуточных продуктов. Это может быть представлено в виде следующей схемы:
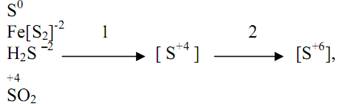
– стадия получения печного газа (оксида серы (4)),
– стадия каталитического окисления оксида серы (4) до оксида серы (6) и абсорбции его (переработка в серную кислоту).
В реальном производстве к этим химическим процессам добавляются процессы подготовки сырья, очистки печного газа, и другие механические и физико-химические операции. В общем случае схема производства серной кислоты может быть выражена в следующем виде:
Сырье→подготовка сырья →сжигание (обжиг) сырья → Очистка печного газа → контактирование → абсорбция → контактированного газа → серная кислота
Конкретная технологическая схема производства зависит от вида сырья, особенностей каталитического окисления оксида (4), наличия или отсутствия стадий абсорбции оксида серы (6).
Химическая и принципиальная схема производства.
Химическая схема получения серной кислоты из колчедана включает три последовательные стадии:
- окисление дисульфида железа пиритного концентрата кислородом воздуха:
4FеS2 +11О2 = 2Fe2О3 + 8 SO2,
- каталитическое окисление оксида серы (4) избытком кислорода печного газа:
2SO2 + О2 = 2SO3,
- абсорбцию оксида серы (6) с образованием серной кислоты:
SO3 +Н2О =H2SO4
По технологическому оформлению производство серной кислоты из железного колчедана является наиболее сложным процессом и состоит из нескольких последовательно проводимых стадий.
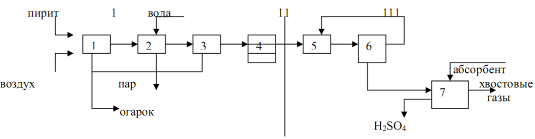
Принципиальная схема этого производства представлена на рисунке.
1 – получение обжигового газа: 1 – обжиг колчедана, 2 – охлаждение газа в котле-утилизаторе, 3 – общая очистка газа, 4 – специальная очистка газа; 11 – контактирование: 5 – подогрев газа в теплообменнике, 6 – контактирование; 111 – абсорбция: 7 – абсорбция оксида серы (6) и образование серной кислоты.
Сернистый ангидрид S02 – это бесцветный газ, в 2.3 раза тяжелее воздуха, с резким запахом. При растворении в воде образуется слабая и нестойкая сернистая кислота SO2 +Н2О = H2SO3.
Рассмотрим производство сернистого газа обжигом основного сырья – колчедана и затем сжиганием серы.
Окислительный обжиг колчедана.
Обжиг колчедана в токе воздуха представляет необратимый некаталитический гетерогенный процесс, протекающий с выделением тепла через стадии термической диссоциации дисульфида железа: 2FеS2 = 2FеS+ S2 и окисления продуктов диссоциации: S2 +2О2 = 2SO2, 4FеS +702 = 2Fе2О3 +4 SO2, что описывается общим уравнением:
4FеS2 + 11 О2 = 2Fе203 + 8SO2 + ДH,
где ДH = 3400 кДж.
Скорость процесса окислительного обжига выражается общим для гетерогенных процессов уравнением:
U = dm/ dф = KmFДС.
где: Км – коэффициент массопередачи.
F – поверхность контакта фаз (катализатора),
ДС – движущая сила процесса.
Таким образом, скорость процесса обжига зависит от температуры (через Км), дисперсности обжигаемого колчедана (через F), концентрации дисульфида железа в колчедане и концентрации кислорода в воздухе (через ДС).
На рисунке представлена зависимость скорости обжига колчедана от температуры (а) и размеров частиц обжигаемого колчедана (б).
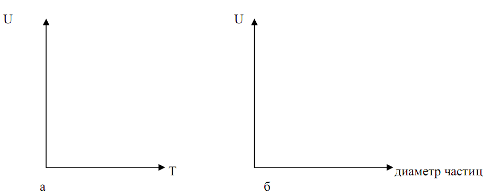
Увеличение движущей силы процесса обжига достигается флотацией колчедана, повышающей содержание дисульфида железа в сырье, обогащением воздуха кислородом и применением избытка воздуха при обжиге до 30 % сверх стехиометрического количества. На практике обжиг ведут при температуре не выше 1000 °С. т. к. за этим пределом начинается спекание частиц.
В качестве реакторов для обжига колчедана могут применяться печи различной конструкции: механические, пылевидного обжига, кипящего слоя (КС). Печи кипящего слоя отличаются высокой интенсивностью (до 10000 кг/м2*сут), обеспечивают более полное выгорание дисульфида железа. Недостаток – повышенное содержание пыли в газе обжига, что затрудняет его очистку.
В н. в. печи КС полностью вытеснили печи других типов в производстве серной кислоты из колчедана.
Продукты окислительного обжига колчедана – обжиговый газ и огарок, состоящий из оксида железа (3), пустой породы и невыгоревшего остатка дисульфида железа. В состав обжигового газа входят оксид серы (4), кислород, азот и незначительное количество оксида серы (6), образовавшегося за счет каталитического действия оксида железа(3). На практике печной газ содержит 13-14% оксида серы (4), 2% кислорода, и около 0.1% оксида серы (6). Т.к. в печном газе должен быть избыток кислорода для последующего окисления оксида серы (4), его состав корректируют, разбавляя воздухом до содержания оксида серы(4) 7–9% и кислорода 9–11%.
Обжиговый газ необходимо очистить от пыли, сернокислотного тумана и веществ, являющихся каталитическими ядами или представляющими ценность как побочные продукты. В обжиговом газе содержится до 300 г./м3 пыли, которая на стадии контактирования засоряет аппаратуру и снижает активность катализатора, а также туман серной кислоты.
Пыль и сернокислотный туман удаляют из обжигового газа в процессе общей очистки газа, которая включает операции механической (грубой) и электрической тонкой) очистки. Механическую очистку газа осуществляют пропусканием газа через центробежные пылеуловители (циклоны) и волокнистые фильтры, снижающие содержание пыли в газе до 10–20 г./м3. После общей очистки обжиговый газ, полученный из колчедана, обязательно подвергается специальной очистке для удаления остатков пыли и тумана и, главным образом, соединений мышьяка и селена, которые при этом утилизируются. В специальную очистку газа входят операции охлаждения его до температуры ниже температур плавления оксида мышьяка и селена в башнях, орошаемых последовательно 50% и 20% серной кислотой, удаления сернокислотного тумана в мокрых электрофильтрах и завершающей осушки газа в скрубберах, орошаемых последовательно 95% серной кислотой. Из системы специальной очистки газ выходит с температурой 1400С.
Контактным способом производится большое количество серной кислоты, в том числе оллеум.
Контактный способ включает три стадии: 1) очистку газа от вредных для катализатора примесей; 2) контактное окислением сернистого ангидрида в серный; 3) абсорбцию серного ангидрида серной кислотой. Главной стадией является контактное окисление SO2 в SO3.
Контактное окисление оксида серы (4)
Реакция окисления оксида серы (4) до оксида серы (6), лежащая в основе процесса контактирования обжигового газа, представляет собой гетерогенно-каталитическую, обратимую, экзотермическую реакцию и описывается общим уравнением: SO2 + 0.5 О2 →SO3 + ДН.
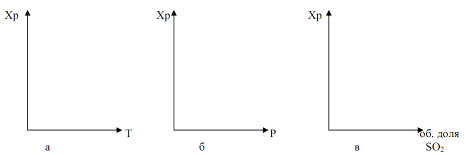
Тепловой эффект реакции зависит от температуры. Система «SO2 – О2 – SO3» характеризуется состоянием равновесия в ней и скоростью процесса окисления оксида серы (4), от которых зависит суммарный результат процесса.
Константа равновесия реакции окисления оксида серы (4) равна:
Кр = р8О3 / р8О2 *PO2,
где: рэО3, р8О2. рО2 – равновесные парциальные давления оксида серы (6), оксида серы (4), и кислорода соответственно.
Степень превращения оксида серы (4) в оксид серы (6) или степень контактирования, достигаемая на катализаторе, зависит от активности катализатора, температуры, давления, состава контактируемого газа и времени контактирования и описывается уравнением:
![]()
Где: рS03, где рS03 и рS02 – те же величины, что и в предыдущем уравнении.
Энергия активации реакции окисления оксида серы (4) кислородом в оксид серы (6) весьма велика. Поэтому в отсутствии катализатора реакция окисления даже при высокой температуре не идет. Применение катализатора позволяет снизить энергию активации реакции и увеличить скорость окисления.
В производстве серной кислоты в качестве катализатора применяют контактные массы на основе оксида ванадия (5) марок БАВ и СВД, названные так по начальным буквам элементов, входящих в их состав:
БАВ (барий, алюминий, ванадий) состава:
V205 (7 %) + K2S04 + ВаS04 + Al2(S04)3 + Si02 (кремнезем)

Предполагается, что процесс окисления оксида серы (4) на этих катализаторах идет через стадию диффузии реагентов к поверхности катализатора, на которой образован комплекс оксида ванадия (5) с активатором, сорбции реагентов на катализаторе с последующей десорбцией продукта реакции (оксида серы(6)):
V205 + S02 = V204 + S03, V204 + 0.502 = V205.
Температура зажигания контактных ванадиевых масс составляет 380–420оС и зависит от состава контактируемого газа, повышаясь с уменьшением содержания в нем кислорода. Обеспечение высокой температуры в начале процесса окисления требует больших затрат энергии на подогрев газа, поступающего на контактирование. Поэтому на практике температуру газа на входе в контактный аппарат, поступающего на первый слой катализатора, задают несколько выше температуры зажигания (4200С). В ходе реакции выделяется большое количество тепла и так как процесс в слое катализатора идет без отвода тепла, то температура газа повышается, после этого газ охлаждается в теплообменнике и направляется на второй слой катализатора, затем снова охлаждают и т.д. Таким образом, противоречие между кинетикой и термодинамикой процесса окисления оксида серы (4)
достаточно успешно снимается конструкцией и температурным режимом работы контактного аппарата на стадии, каждая из которых отвечает оптимальным условиям протекания процесса контактирования: температура 4000С, давление 0.1 Мпа, содержание оксида серы (4) в газе 0.07 об. долей, содержание кислорода в газе 0.22 об. долей.
Реакторы или контактные аппараты для каталитического окисления оксида серы по своей конструкции делятся на аппараты с неподвижным слоем катализатора (полочные, фильтрующие), в которых контактная масса расположена в 4–5 слоях и аппараты кипящего слоя. Отвод тепла после прохождения газом каждого слоя катализатора осуществляется путем введения в аппарат холодного газа или воздуха, или с помощью встроенных в аппарат или вынесенных отдельно теплообменников. Совокупность контактного аппарата, теплообменников и газопроводов представляет контактный узел.
Для увеличения конечной степени контактирования применяют метод двойного контактирования и ведут процесс окисления оксида серы в две стадии. На первой стадии контактирование ведут до степени превращения не превышающей 0.90–0.91 дол. единицы, после чего из контактированного газа выделяют оксид серы (6). Затем проводят вторую стадию контактирования до степени превращения оставшегося в газе оксида серы (4) 0.95 дол. единицы. Метод двойного контактирования позволяет повысить степень контактирования до 0.995 дол. ед. и на несколько порядков снизить выброс оксида серы (4) в атмосферу.
Абсорбция оксида серы.
Последней стадией в производстве серной кислоты контактным способом является абсорбция оксида серы (6) из контактированного газа и превращение его в серную кислоту или олеум.
Абсорбция оксида серы (4) представляет обратимую экзотермическую реакцию и описывается уравнением:
nSO3 + Н2О → H2SO4 + (n -1) SO3 + ДН
В зависимости от количественного соотношения оксида серы (6) и воды может быть получен продукт различной концентрации: при n >2 олеум, при n =1 моногидрат (100 % серная кислота), при n <1 водный раствор кислоты (разбавленная серная кислота).
Наилучшей поглощающей способностью обладает азеотроп серной кислоты концентрацией 98.3%. Использование кислоты более низкой концентрации приводит к интенсивному образованию тумана, а применение олеума к снижению степени абсорбции. Абсорбция оксида серы сопровождается выделением значительного количества тепла. Поэтому для обеспечения полноты поглощения оксида серы (6) процесс ведут при охлаждении газа и используют аппараты с большим абсорбционным объемом, обеспечивающие интенсивный отвод тепла. С этой же целью процесс абсорбции ведут в две стадии, используя на первой в качестве сорбента 20%-ный олеум, а на второй 98.3-ную кислоту.
Технологическая схема производства серной кислоты контактным методом. В н. в. в производстве серной кислоты контактным методом наиболее распространенной является схема с использованием принципа двойного контактирования «ДК-ДА» (двойное контактирование – двойная абсорбция). Производительность установки до 1500 т/сут. Расходные коэффициенты: колчедан 0.82 т, вода 50 м3, электроэнергия 82 кВт*ч
Сжигание серыпроисходит значительно проще и легче, чем обжиг колчедан. Технологический процесс производства серной кислоты из элементарной серы отличается от процесса производства из колчедана следующими особенностями:
· особая конструкция печей для получения печного газа;
· повышенное содержание оксида серы (4) в печном газе;
· отсутствие стадии предварительной очистки печного газа.
Принципиальная схема производства серной кислоты из серы представлена на рисунке:
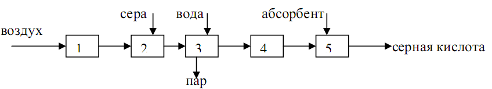
1 – осушка воздуха, 2 – сжигание серы, 3 – охлаждение газа,
4 – контактирование, 5 – абсорбция оксида серы (6).
Фактически сера перед горением плавится и испаряется и сгорает в газовой фазе. Горение серы представляет гомогенную экзотермическую реакцию, которой предшествует процесс перехода твердой серы в жидкое состояние и ее последующее испарение:
![]()
Таким образом, процесс горения протекает в газовой фазе в потоке предварительно высушенного воздуха и описывается уравнением:
S + О2 = SO2 + ДH
Для сжигания чистой серы применяют форсуночные и циклонные печи. Перед подачей в печь серу плавят в плавильном котле глухим паром, отфильтровывают от примесей и распыляют сжатым воздухом через форсунку в печи; при этом сера испаряется и сгорает. В форсуночной печи перешивание серы с воздухом недостаточное, тормозится процесс диффузией и происходит экстенсивно. В циклонной печи благодаря тангенциальному подводу воздуха происходит исключительно сильное перешивание паров серы с воздухом и интенсивность сгорания увеличивается.
Печной газ при сжигании серы отличается более высоким содержанием оксида серы (4) и не содержит значительного количества пыли. При сжигании самородной серы в нем также отсутствуют соединения мышьяка и селена, являющимися каталитическими ядами.
Товарные сорта серной кислоты
Современная промышленность выпускает несколько сортов серной кислоты и олеума, различающихся концентрацией и чистотой. Чтобы уменьшить возможность кристаллизации продуктов при перевозке и хранении, а также в самом производстве, установлены стандарты на товарные сорта, концентрации которых отвечают эвтектическим составам с наиболее низкими
| Сорт продукта |
Содержание Н2 SO4% |
Содержание св. SO3, % |
Температура, 0С |
| Башенная к-та | 75 | 0.0 | -29.5 |
| Контактная к-та | 92.5 | 0.0 | -22 |
| олеум | 104.5 | 20 | +2.0 |
| Высокопроцент. | 114.6 | 65 | -0.35 |