
Рефераты по рекламе
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Рефераты по строительным наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Рефераты по сексологии
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Реферат: Исследование возможностей синтеза фенилселиконатов натрия, содержащих в своем составе атом кобальта
Реферат: Исследование возможностей синтеза фенилселиконатов натрия, содержащих в своем составе атом кобальта
Министерство образования и науки Российской Федерации
Федеральное государственное автономное образовательное учреждение
Дальневосточный Федеральный Университет
Институт химии и прикладной экологии
Кафедра неорганической и элементоорганической химии
Исследование возможностей синтеза фенилселиконатов натрия, содержащих в своем составе атом кобальта
Владивосток
2011
Оглавление
Введение
1. Литературный обзор
1.1 Методы синтеза полиметаллоорганосилоксанов
1.1.1 Взаимодействие органилсиланолятов щелочных металлов с хлоридами металлов
2. Обсуждение результатов
3. Экспериментальная часть
3.1 Синтез полифенилсилоксана (ПФС)
3.2 Синтез кристаллосольвата фенилсилантриолята натрия с ДМСО (ФСТН)
3.3 Синтез поликобальтфенилсилоксана
3.4 Взаимодействие поликобальтфенилсилоксана с гидроксидом натрия
3.5 Исследование взаимодействия поликобальтфенилсилоксана с фенилсилантриолятом натрия
3.6 Анализ мононатровой и тринатровой соли фенилтригидроксисилана на натрий
3.7 Определение кремния гравиметрическим методом
Выводы
Список литературы
Введение
Кремнийорганические полимеры, содержащие в своей структуре гетеросилоксановую группировку Si-O-Э (под символом Э подразумевается гетероатом, за исключением атомов водорода и углерода), носят название полигетеросилоксаны. Если элемент является металлом, они классифицируются как полиметаллоорганосилоксаны (ПМОС). Первые полученные в 50г ХХ века, исследования были доведены до промышленного внедрения [1].
Интерес к химии полигетеросилоксанов обусловлен специфическими свойствами и реакционной способностью силоксановой связи и группировки Si–O–M, спектр свойств которых достаточно широк. Ранее было показано, что полигетеросилоксаны, содержащие в своем составе d-элементы обладают высокой термостойкостью, а также выступают в качестве эффективных термостабилизаторов полидиметилсилоксанового каучука (СКТН) и катализаторов некоторых органических реакций [2-4]. Так же полиметаллоорганосилоксаны используются в качестве стойких антикоррозийных покрытий, защитных лаков, катализаторов в нефтеперерабатывающей промышленности [5].
Взаимодействие полиметаллофенилсилоксанов с электрофильными реагентами в частности с кислотами достаточно хорошо изучено.[8] Их взаимодействие с нуклеофильными реагентами практически не изучено. В то же время при взаимодействии полиметаллофенилсилоксанов (содержащих олово и германий органические фрагменты) с такими электрофильными реагентами как спирты, происходит образование мономерных функциональных гетеросилоксанов.
Целью данной работы является исследование возможности синтеза фенилсиликонатов натрия содержащих в своем составе атомы кобальта.
1. Литературный обзор
1.1 Методы синтеза полиметаллоорганосилоксанов
В данное время существует пять основных путей формирования гетеросилоксановой группировки: реакции гидролитической и гетерофункциональной поликонденсации, взаимодействие органилсиланолятов щелочных металлов с галогенидами металлов, расщепление силоксановой связи оксидами элементов и методом механохимической активации. Методы были описаны авторами в следующих работах. [1, 6-12]
1.1.1. Взаимодействие органилсиланолятов щелочных металлов с хлоридами металлов
Наиболее удобным в препаративном отношении и универсальным методом синтеза ПМОС является метод, основанный на взаимодействии хлоридов металлов с органилсиланолятами щелочных металлов [13-16]. Данный способ практически незаменим для получения ПМОС циклолинейного строения.
Данный метод образования полимеров отражен следующими схемами:
RSi(OH)2ONa+MYx→M[O(OH)2SiR]x+xNaY (1)
M[O(OH)2SiR]x→{[RSi(O)1.5MOx/2}+xH2O (2)
Методика получения ПМОС состоит из двух стадий: сначала при действии дозированного количества щелочи на органосилоксан получают органосиланолят, далее с помощью обменной реакции органосиланолята и галогенида поливалентного металла формируют металлосилоксановый фрагмент Si-O-M-O-Si, при этом металл "встраивается" в силоксановую цепь. Несмотря на кажущуюся простоту данных схем, соотношение кремния к металлу в получаемых полигетеросилоксанах часто отличается от исходного, они неоднородны по составу, что указывает на сложность процессов полимерообразования. Предложены методы синтеза в водно-органических средах: в этом случае соотношение кремния к металлу в полимерах зачастую сильно завышены относительно исходного и они неоднородны по составу [14,17].
По мнению ряда других авторов при проведении процесса в водно-органических средах преобладающее влияние оказывает гидролиз исходных соединений: реакция по своему характеру мало чем отличается от согидролиза [18].
Методом, основанным на взаимодействии хлоридов металлов с мононатровыми солями органилсилантриолов в безводной среде удается достигнуть значительно лучших результатов. При проведении процесса в среде инертного растворителя, выход полимера значительно улучшается в присутствии бутилового спирта, вероятно вследствие гомогенизации системы [18]. Но данный способ является технологически более трудоемким из-за трудностей получения безводных хлоридов металлов. Однако и в этом случае в реакционной системе будет содержаться некоторое количество воды [19].
Для исключения влияния побочных процессов был предложен новый метод получения ПМОС в среде диметилсульфоксида (ДМСО), который эффективнее чем вода сольватирует ионы металлов [20]. Насыщая координационную сферу металла, ДМСО препятствует протеканию нежелательных побочных процессов, что приводит к получению ПМОС более регулярного строения. Предложенный метод не требует использования в синтезе ПМОС безводных галогенидов металлов и абсолютных растворителей. В полученных полимерах сохраняются соотношения кремния к металлу и они практически однородны по составу.
Метод получения каркасных и полимерных металлоорганосилоксанов, в котором использовали для синтеза полиметаллоорганосилоксанов не силаноляты натрия, полученные щелочным расщеплением предварительно синтезированных полиорганосилоксанов, а мономерные органотриалкоксисиланы предложен авторами [21]. Суть метода заключается в том, что органотриалкоксисилан обрабатывают водно-метанольным раствором едкого натра, причем количество воды должно обеспечивать полный гидролиз алкоксигрупп.
2. Обсуждение результатов
Нами было проведено исследование взаимодействия поликобальтфенилсилоксана по следующей схеме:
(PhSiO1,2)2CoO + 2NaOH → [PhSi(O)O0,5NaCoO]n + H2O (3)
Схема взаимодействия предполагает образование продуктов циклического или олигомерного характера.
Синтез осуществлен в условиях аналогичных для синтеза мононатровой соли фенилсилантриола в водно-ацетоновой среде. Исходный поликобальтфенилсилоксан был синтезирован по раннее описанной методике в присутствии диметилсульфоксида.[20] В результате синтеза наряду с полимерными продуктами были выделены белое кристаллическое вещество, состав которого отвечает финилсилантриоляту натрия: PhSi(ONa)3 × 6,5H2O, ИК-спектр представлен на рисунке 1.
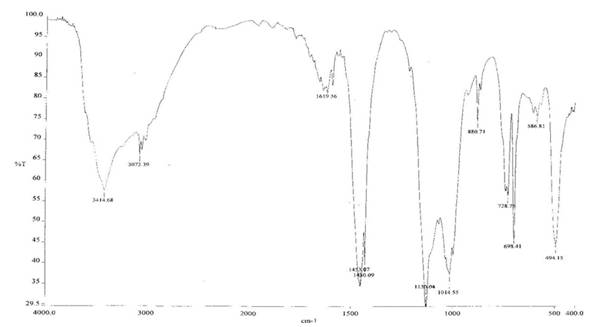
Рис.1 синтезирование полифенилсилоксан натрий гравиметрический
В ИК-спектре соединения в области 1100 см-1 поглощение имеет относительно простую колебательную структуру, что указывает на мономерный характер полученного соединения. В этой области отсутствуют максимумы поглощения которые соответствовали бы колебаниям связи Si-O в циклических и олигомерных продуктах. Присутствует лишь полоса поглощения при 1130 см-1, 1430 см-1(характеристическая полоса для связи Si-Ph) и 1600 см-1, триплет в области 3100 см-1 отвечает колебаниям связи C-H в алифатическом радикале. Выход фенилсилантриолята натрия составил 80 % от теоретически возможного. Таким образом взаимодействие протекает не согласно предполагаемой схеме реакции, а по следующей схеме:
(PhSiO1,5)2Co + 2NaOH → 0,7(PhSi(ONa)3) + (PhSiO1,5)1,33CoO + H2O (4)
Так как взаимодействие между реагентами не приводит к желаемому результату, нами была исследована возможность синтеза подобных соединений по следующей схеме:
CoCl2 + 2(NaO)3SiPh → Co[OSiPh(ONa)2]2 + 2NaCl (5)
Фенилсилантриолят натрия получен по раннее описанной методике. Синтез вели в условиях оптимальных для синтеза поликобальтфенилсилоксана, в среде смеси растворителей диметилсульфоксида и бензола. В результате взаимодействия было получено твердое вещество синего цвета. Разделить продукты взаимодействия не удалось. Их обработка избытком триметилхлорсилана с целью перевода кобальт содержащих компонентов в растворимое состояние также не увенчалось успехом.
Предполагаемая схема взаимодействия:
Co[OSiPh(ONa)2]2 + 4(CH3)3SiCl → Co[OSiPh(OSi(CH3)3)2]2 + 4NaCl (6)
Однако в результате синтеза, растворимые продукты взаимодействия представляли из себя жидкое бесцветное вещество, которое не перегоняется в вакууме при 100 °С/20 мм.рт.ст.
ИК-спектр полученного соединения представлен на рисунке 2.
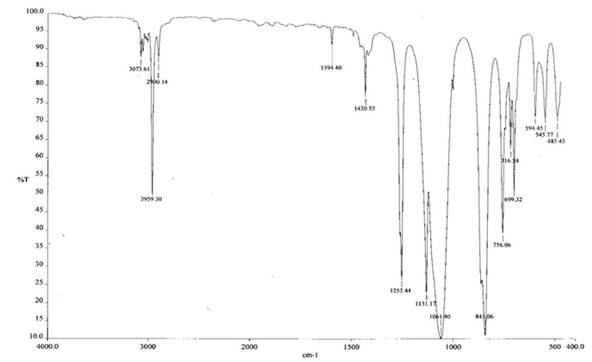
Рис.2
Спектр имеет простую колебательную структуру. В области 1000 – 1100 см-1 имеется только один максимум поглощения при 1061 см-1 отвечающий колебаниям связи Si-O, максимум при 1131 см-1 и 1430 см-1 отвечает колебаниям связи Si-Ph, 1251 см-1 отвечает присутствию атома кремния связанного с тремя метильными радикалами. Таким образом можно сделать предварительный вывод, что выделенное вещество является трис-(триметилсилокси)фенилсилоксаном, его количество практически полностью соответствует введенному количеству фенилсилантриолята натрия. Не растворимое в органических растворителях вещество синего цвета по данным элементного анализа не содержит в своем составе кремний. Оно хорошо растворимо в воде с образованием раствора розового цвета и по видимому представляет собой кристаллосольват хлорида кобальта с диметилсульфоксидом
Таким образом, под действием избытка триметилхлорсилана, по-видимому происходит разрушение образующихся кобальт содержащих гетеросилоксанов и сделать окончательный вывод о их природе и составе на основании проведенных исследований не представляется возможным.
3. Экспериментальная часть
3.1 Синтез полифенилсилоксана (ПФС)
В трехгорлую колбу, снабженную механической мешалкой, обратным холодильником и капельной воронкой, помещали 400 мл воды и 200 мл диэтилового эфира. При охлаждении и энергичном перемешивании вводили в реакционную колбу 100 мл (0.3 моль) фенилтрихлорсилана в 100 мл диэтилового эфира так, чтобы не происходило сильного разогревания реакционной среды, охлаждали колбу льдом. После чего смесь перемешивали еще в течение 2 часов. В делительной воронке отделяли водный слой от эфирного, последний промывали водой до нейтральной реакции по универсальному индикатору и сушили над свежепрокаленным хлористым кальцием.
Растворитель отгоняли при 80 °C/10 мм.рт.ст., ПФС сушили до постоянного веса. Получили 38,1 г ПФС, что составляет 98,4 % от теоретического выхода.
3.2 Синтез кристаллосольвата фенилсилантриолята натрия с ДМСО (ФСТН)
К раствору 15,96 г (0,12моль) полифенилсилоксана в 360 мл смеси толуол – этанол 1:1 прибавили 14,88 г (0,37 моль) гидроксида натрия и нагревали с обратным холодильником до полного растворения гидроксида натрия. Прибавили 120 мл ДМСО, растворитель частично отогнали при (t= 75-80 °C) до начала выпадения белых кристаллов. После охлаждения выпавшие кристаллы отделили на воронке Бюхнера и сушили до постоянного веса в вакууме при температуре 40°C и давлении 12 мм.рт.ст. По данным элементного анализа на Na, состав выпавшего осадка отвечает следующей формуле: PhSi(ONa)3 × 0,64ДМСО (Найдено: % Na = 25,4; вычислено % Na = 25,3) Выделено 32,1 г что составляет 98,6%.
3.3 Синтез поликобальтфенилсилоксана
К раствору 27,5 г (0,2 моль) ПФС в 276 мл бензола прибавляли 8 г (0,2 моль) гидроксида натрия и 78 мл (1 моль) диметилсульфоксида (ДМСО). Синтез проводили при температуре кипения растворителей до прекращения выделения воды в ловушку Дина-Старка и полного растворения щелочи. Полученный раствор фенилсиликоната натрия использовали для синтеза поликобальтфенилсилоксана без выделения первого.
В трехгорлую колбу, снабженную механической мешалкой, ловушкой Дина-Старка и обратным холодильником, помещали 23,8 г (0,1 моль) СоСl2 × 6Н2О, 93,6 мл диметилсульфоксида (ДМСО) и 200 мл бензола. Смесь кипятили до прекращения выделения воды в ловушку Дина-Старка. К полученной суспензии прибавляли раннее полученный раствор фенилсиликоната натрия. Синтез вели в течении четырех часов без нагревания до приобретения раствором интенсивно синей окраски, затем при температуре кипения растворителей – до прекращения выделения воды в ловушку Дина-Старка. Выпавший осадок хлорида натрия отделяли центрифугированием. Из центрифугата бензол удаляют перегонкой, в конце под разрежением (насос Камовского). Раствор полимера в ДМСО, при энергичном перемешивании приливали к четырехкратному объему воды, выпавший осадок поликобальтфенилсилоксана отделяли фильтрованием и промывали водой. Полимер сушили в вакууме до постоянного веса. Получено 31,5 г полимера что составляет 94,8 % от теоретически возможного.
3.4 Взаимодействие поликобальтфенилсилоксана с гидроксидом натрия
К раствору 3,3 г (0,01 моль) поликобальтфенилсилоксана в 30 мл ацетона прибавляли 0,8 г (0,02моль) гидроксид натрия. Постепенно прибавляя воду синтез вели при нагревании до полного растворения гидроксида натрия и образования гомогенного раствора. Выпавшие при охлаждении бесцветные кристаллы отделяли фильтрованием на фильтре Шота. Масса выделившихся кристаллов составляет 1,75 г. По данным элементного состава их состав отвечает формуле: PhSi(ONa)3 × 6,5H2O (Найдено: % Si = 7,9; %Na = 20,3. Вычислено: % Si = 8,2; % Na = 20,3.) Количество выделенного фенилсилантриолята натрия составляет 80 % от теоретически возможного в пересчете на NaOH.
3.5 Исследование взаимодействие поликобальтфенилсилоксана с фенилсилантриолятом натрия
В колбу снабженную ловушкой Дина-Старка и обратным холодильником помещали 1,66 г (0,007 моль) СоСl2 × 6Н2О, 7 мл диметилсульфоксида (ДМСО) и 50 мл бензола. Смесь кипятили до прекращения выделения воды в ловушку Дина-Старка. К полученной суспензии прибавляли 3,08 г (0,014 моль) PhSi(ONa)3 × 0,64ДМСО. Реакционную смесь перемешивали до полного обесцвечивания раствора в конце при нагревании. К реакционной смеси при охлаждении и перемешивании прибавляли 7 мл (0,049 моль) триметилхлорсилана. Нерастворимые продукты отделяли фильтрованием. Фильтрат промывали водой для удаления ДМСО и сушили над хлористым кальцием. После отгонки растворителя выделено 3,75 г (72,1 %) кремнеорганических продуктов которые по данным ИК спектроскопии отвечает следующей формуле: PhSi[OSi(CH3)3]3.
3.6 Анализ мононатровой и тринатровой соли фенилтригидроксисилана на натрий
Навеску тринатровой соли массой 0,2г помещали в коническую колбу прибавляли 25 мл 0,1 н раствора соляной кислоты. Раствор нагревали до кипения и титровали раствором щелочи с точно известным титром. В качестве индикатора использовали метилоранж, переход окраски от розовой в желтую. Процентное содержание натрия рассчитывли по формуле:
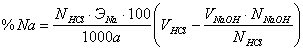 ,
,
а – навеска вещества, г;
ЭNa – эквивалент натрия, г.
Состав анализируемой соли отвечал следующей бруттоформуле PhSi(ONa)3 × 0,64ДМСО.
3.7 Определение кремния гравиметрическим методом
К навеске 0,2г анализируемого вещества прибавили 2,5 г иодата калия и 20 мл серной кислоты. Анализируемую смесь упарили досуха. После охлаждения прибавляли 50 мл соляной кислоты (3:2) и 350 мл воды, доводили до кипения. Отфильтровывали осадок и прокаливали до постоянного веса при T = 1000ºC. Процент кремния прасчитывали по следующей формуле:
![]()
0,4672 – фактор пересчета
а - масса навески
ИК – спектры регистрировались на приборе SPEKTRUM 1000 BX-║KBr и тонком слое.
Выводы
1. Взаимодействие поликобальтфенилсилоксана с гидроксидом натрия ведет к разрушению гетеросилоксанового фрагмента с образованием фенилсилантриолята натрия.
2. Продукты взаимодействия хлорида кобальта и фенилсилантриола натрия в мольном соотношении 1:2, разрушаются под воздействием триметилхлорсилана, что ведет к образованию трис-(триметилсилокси) фенилсилоксана.
Список литературы
1 Андрианов, К.А. Технология элементоорганических мономеров и полимеров./ К.А. Андрианов, Л.М. Хананашвили – М. : Химия, 1973. – 400с.
2 Соболевский, М.В. Свойства и области применения кремнийорганических продуктов./ М.В.Соболевский, О.А. Музовская, Г.С. Попелева. – М. : Химия, 1975. – 295с
3 Каталитическая активность магнийорганосилоксанов. И.М. Колесников, Г.М. Панченков, К.А. Андрианов, А.А. Жданов, Н.Н. Белов, М.М. Левицкий : Изв.АН ССР. Сер.хим., 1976. - №6, 473 – 474с.
4 Свидерский, В.А. деструкция и стабилизация полимеров : тезисы докладов 9-ой конференции./ В.А. Свидерский, Н.А. Ткач. – М. : 2001. – 172–173с.
5 Талашкевич, Е.А. Твердофазный синтез полиметаллооргансилоксанов : международная научно – практическая конфренция./ Е.А. Талашкевич, Е.Ю. Гаденко, Л.В. Шевченко. – Находка. : 1999. – 32–33.
6 Андрианов, К.А. Методы элементоорганической химии. Кремний. / К.А. Андрианов. – М : Наука, 1976. – 560с.
7 Жданов, А.А. Новые проблемы в синтезе и изучении свойст полиметаллоорганосилоксанов.: Тез.док. Всерос. Конф. "Кремний органические соединения. Синтез, свойства, применение". / А.А. Жданов. – М : 2000. – 113с.
8 Воронков, М.Г. Гетеросилоксаны. / М.Г. Воронков, Е.А. Малетина, В.К. Роман. – Новосибирск. : Наука, 1984. – 495с.
9 Воронков, М.Г. Силоксановая связь. / М.Г. Воронков, В.П. Милешкевич, Ю.А. Южелевский. – Новосибирск. : Наука, 1976. – 414с.
10 Борисов, С.Н. Кремнеэлементоорганические соединения./ С.Н. Борисов, М.Г. Воронков, Э.Я. Лукевиц. - Л.:.Химия, 1966. – 542с.
11 Талашкевич Е.А. Получение полиметаллорганосилоксанов методом механохимической активации и исследование их свойств : Автореф. Дис. кан. хим. наук. / Е.А. Талашкевич. – Владивосток : 2000. – 28с.
12 Синтез и исследование дикалиевых производных олигодиорганилсилоксан-α, ω-диолов. / Н.П. Шапкин, А.А. Капустина, Н.И. Симанчук, Е.В. Моисеева. – Известия вузов. Химия и хим.техн., 1995. – Т.38, Вып.3. 24-29с.
13 Жданов, А.А. Синтез и исследование свойств полиметаллоорганосилоксанов. / А.А. Жданов, К.А. Андрианов, М.М. Левицкий.// ВМС. – 1976. – т.18. №10. 2264-2269с.
14 Шапкин, Н.П. Дис. канд.хим.наук./ Н.П. Шапкин. – Владивосток, 1971. – 155с.
15 Щеголихина, Н.А. Дис. канд.хим.наук./ Н.А. Щеголихина. – Иркутск, 1981. – 122с.
16 Шапкина, В.Я. Дис. канд.хим.наук./ В.Я. Шапкина. – Владивосток, 1983. – 146с.
17 Андрианов, К.А. Синтез полиферроорганосилоксанов и полиферроалюмоорганосилоксанов./ К.А. Андрианов, Т.Н. Ганина, Н.Н. Соколов.// ВМС. – 1962. – т.4.№5.678-682с.
18 Жданов, А.А.Исследование в области полиэлементоорганосилоксанов: Дис. докт.хим.наук./ А.А. Жданов.. – Москва. ИНЭОС. 1983. – 146с.
19 Жданов, А.А. Особенности синтеза металлосилоксанов каркасной структуры./ А.А. Жданов, О.И. Щеголихина, Ю.А. Молодцова. // Изв.АН РФ. Сер. хим. – 1993. - №5. 957-961с.
20 Воронков, М.Г. Новый способ получения полиметаллофенилсилоксанов. / М.Г. Воронков, А.В. Аликовский, Г.Я. Золотарь.// Докл. АН СССР. – 1985. – т.281.№4. 858-860с.