
Рефераты по рекламе
Рефераты по философии
Рефераты по финансам
Рефераты по химии
Рефераты по цифровым устройствам
Рефераты по экологическому праву
Рефераты по экономико-математическому моделированию
Рефераты по экономической географии
Рефераты по экономической теории
Рефераты по этике
Рефераты по юриспруденции
Рефераты по языковедению
Рефераты по юридическим наукам
Рефераты по истории
Рефераты по компьютерным наукам
Рефераты по медицинским наукам
Рефераты по финансовым наукам
Рефераты по управленческим наукам
Рефераты по строительным наукам
Психология педагогика
Промышленность производство
Биология и химия
Языкознание филология
Издательское дело и полиграфия
Рефераты по краеведению и этнографии
Рефераты по религии и мифологии
Рефераты по медицине
Рефераты по сексологии
Рефераты по москвоведению
Рефераты по экологии
Краткое содержание произведений
Рефераты по физкультуре и спорту
Топики по английскому языку
Рефераты по математике
Рефераты по музыке
Остальные рефераты
Дипломная работа: Экологическая безопасность при обработке конструкций кондиционеров
Дипломная работа: Экологическая безопасность при обработке конструкций кондиционеров
Государственный комитет Российской Федерации
по высшему образованию
Московский государственный технологический
Университет «станкин»
Факультет физико-технический.
Кафедра Общей и прикладной химии
Выпускная работа
На соискание академической степени бакалавра
Техники и технологии по направлению 552900
«Технология, оборудование и автоматизация
машиностроительных производств»
Тема:
Экологическая безопасность при обработке конструкций кондиционеров завода «Кондиционер».
Студент Кынтикова Е.А.
Группа Ф-8-1
Руководитель работы к.н.х., доц. Ромина Н.Н.
Дата: __________
Консультант к.х.н., доц. Соловьев Г.С.
Дата: ___________
Допускается к защите
Зав. Кафедрой Козлов Г.В.
Дата: __________
Москва 2000 год.
содержание.
1. Введение. 5
2. Обзор литературы 9
2.1. Рациональное водопотребление в гальваническом производстве. Структура водопотребления. 9
2.1.1 Промывка 9
2.2 Очистка сточных вод от ионов тяжелых металлов. 11
2.3 Очистка сточных вод от ионов хрома. 13
2.3.1 Источники поступления соединений хрома в сточные воды. 13
2.3.2 Современные методы очистки сточных вод от ионов хрома. 15
2.4 Физико-химические методы очистки вод. 16
2.4.1 Флотация. 17
2.5. Электрохимические методы очистки сточных вод 19
2.5.1 Электрофлотация. 20
2.5.2 Электрофлотационный метод извлечения ионов металлов из стоков гальванопроизводств. 21
2.5.3 Электрофлотационные установки. 22
2.5.4. Физико-химические аспекты электрофлотации. 26
3. Выводы из литературного обзора. 27
4. Выбор и обоснование электрофлотационного способа обезвреживания сточных вод.
4.1. Электрофлотационный метод извлечения ионов металлов из стоков гальванопроизводств 28
4.2. Ионный обмен. 31
4.3. Реагентная очистка сточных вод от шестивалентного хрома. 32
4.4. Вывод. 38
5. Экспериментальная часть. 40
5.1. Описание установки. 41
5.2. Исследуемые вещества 44
5.3. Методика проведения опыта. 46
5.4. Результаты снятия вольт-амперных характеристик. 50
Обсуждение результатов. 52
6. Расчет основного оборудования и основных операций. 53
6.1. Материальные потоки в электрофлотаторе. 53
6.2. Определение расхода воды при элктрофлотации. 53
6.2.1 Определение количества образовавшихся газов 54
6.2.2. Определение количества растворителя (воды), уносимого с газообразными продуктами
6.3. Энергетический баланс электрофлотатора. 55
6.4. Расчет теоретического напряжения разложения 56
6.5. Определение перенапряжения на электродах 58
6.6. Расчет падения напряжения в электролите 58
6.7. Баланс напряжений на электрофлотаторе. 60
6.8. Расчет расхода электроэнергии на электрофлотацию. 60
7. Оборотная вода. 61
7.1. Камера окраски двухсекционная. 61
7.2. Схема камеры окраски. 62
7.3. Изменение состава воды. 63
7.4. Расчет оборота воды в камере окраски. 63
7.4.1. Данные для расчета. 63
7.4.2. Расчет величины испарения и количества добавляемой воды. 63
7.4.3. Расчет продувки системы. 64
8. Выводы. 66
9. Основные понятия и определения. 67
10. Список литературы. 69
Цель и задача работы: проанализировать цех покраски деталей и технологию нанесения гальванических покрытий с точки зрения обеспечения экологической безопасности производства.
В задачи проектного исследования входило совершенствование системы обезвреживания и очистки промывных вод гальванического производства и вод завесы окрасочной камеры.
В системе промывных сточных вод предполагается использование электрофлотационного модуля для выделения твердой фазы осадков, содержащих ионы тяжелых металлов. В этой части предполагается так же выполнение экспериментальных исследований на выяснение принципиальной возможности использования электрофлотации для данных вод производства, а так же оценки составляющих энергетического и теплового баланса, определение удельного расхода на обработку.
Предполагается разработать технологическую схему обработки промывных стоков гальванического производства и сделать поверочный расчет электрофлотатора на производительность данных сточных вод.
В частности решения кондиционирования вод, используемых в системе водяной завесы в окрасочной камере. Предполагается обеспечить ее использование в замкнутом цикле.
ВВЕДЕНИЕ.
В последние годы существенно обострились проблемы, связанные с загрязнениями воды. Сброс неочищенных или плохо очищенных сточных вод в различные водоемы только из-за нехватки кислорода может привести к исчезновению всякой жизни в воде. Кардинальное решение проблемы охраны окружающей среды состоит в разработке и внедрении экологически безопасных, безотходных технологических процессов и производств. Рациональное использование природных ресурсов и охрана окружающей среды в настоящее время решаются в двух направлениях.
Одно из них – разработка и внедрение малоотходных и безотходных технологий и процессов, другое – модернизация действующих предприятий, замена устаревших процессов новыми, повышение качества очистки газообразных выбросов, сточных вод, внедрение замкнутых производственных циклов («Оборотная вода»).
Современный уровень технологии очистки сточных вод позволяет получить воду практически любой степени чистоты. Поэтому можно считать, что загрязнение водоемов происходит по причине не технического, а экономического характера. Чем меньше свежей воды использует предприятие на 1 тонну продукта, тем экологически совершеннее его система водоснабжения. При этом большое значение имеет кратность (повторность) использования в производстве. Кратность k использования воды можно рассчитать по формуле: k=Vi/V0 , где Vi – общий объем воды; V0 – объем свежей воды.
В настоящее время в оборотных системах циркулирует примерно 215 км3 воды, что составляет две трети всего объема воды, используемого промышленностью. На одну треть сократился сброс загрязнений в водоемы. Количество вредных веществ, выбрасываемых стационарными источниками, уменьшилось на 13%.
Из сточных вод легче всего удаляются органические вещества, труднее всего – соли тяжелых металлов.
В различных отраслях народного хозяйства, в первую очередь, в машиностроении, широко применяется технология нанесения гальванических покрытий. Гальваническое производство является одним из крупных потребителей цветных металлов и достаточно дорогих химикатов. При химических покрытиях и подготовительных операциях потери химикатов с промывными водами иногда в десятки раз превышает их расход на обработку поверхности. Расход воды на промывку после подготовительных операций в 3-7 раз превышает расход воды на промывку после гальванических покрытий. Таким образом, гальваническое производство является одним из крупнейших потребителей воды, а его сточные воды – одними из самых токсичных и вредных.
Снижению количества сточных вод может способствовать применение новой технологии производства. Это связано со значительными материальными затратами. Поэтому используют другой путь – повышение эффективности очистки сточных вод.
Основным видом отходов в гальваническом производстве являются промывные воды смешанного состава, содержащие несколько видов тяжелых металлов, объединяют с кислотно-щелочными.
Очистка таких стоков затруднена, так как не удается выделить металлы из шлама сложного состава. Для снижения количества тяжелых металлов в сточных водах до предельно допустимых концентраций (ПДК) необходимо использовать замкнутую систему водоснабжения с электрофлотационной очисткой, то есть промывные воды, подвергшиеся очистке от примесей, возвращать в технологический процесс, а извлеченные примеси – на захоронение или переработку.
Таким образом, очистка сточных вод является одной из самых актуальных проблем. В Западной Европе оборот только промывных вод гальванических производств составляет 97-98% от общего числа стоков. В нашей стране уровень очистки сточных вод и, в частности, регенерации из них цветных металлов, составляет не более 10%.
Основным компонентом сточных вод гальванических производств являются промывные воды, которые в больших количествах используются в производстве. Из ионов тяжелых металлов, находящихся в сточных водах, наиболее распространенными являются хром, никель и медь.
Хромсодержащие стоки образуются в результате промывки деталей после хромирования, электрохимического полирования и удаления некачественных покрытий.
Основные вещества, подлежащие обезвреживанию – шестивалентные соединения хрома, цианиды (CN-), ионы тяжелых и цветных металлов: Cu2+, Ni2+, Zn2+, Cd2+, Sn2+, Pb2+.
Соединения хрома (III), а особенно, хрома (VI) токсичны для человека и животных. Смертельная доза K2Cr2О7 (дихромат калия) для человека составляет 0,2-0,3гр. Поэтому очистка сточных вод гальванического производства от отходов соединений трех- и шестивалентного хрома является актуальной. Наиболее перспективным и эффективным методом очистки сточных вод гальванического производства является электрофлотационный. преимущества этого метода – относительная простота конструкции установки, высокая надежность и высокая степень очистки.
Гальваническое производство является одним из крупнейших потребителей воды, а его сточные воды – одними из самых токсичных и вредных. В связи с этим, перед гальваническим производством встает ряд важных проблем. Снижению количества сточных вод может способствовать применение новой технологии производства. Это потребует значительных материальных затрат, что нереально на данном уровне развития экономики страны. В результате остается другой путь сохранения окружающей среды – повышение эффективности очистки сточных вод.
Основным видом отходов в гальваническом производстве являются промывные воды смешанного состава, содержащие несколько видов тяжелых металлов и других примесей. Очистка таких стоков затруднена. При этом не удается выделить металлы из шлама сложного состава, а если и удается, то возникают проблемы с дальнейшим использованием и переработкой отходов. Для решения проблемы снижения количества тяжелых металлов в сточных водах до ПДК необходимо использовать замкнутую систему водоснабжения с электрофлотационной очисткой, то есть промывные воды, подвергшиеся очистке от примесей возвращать в технологический цикл, а извлеченные примеси – на захоронение или переработку. Т.о., очистка сточных вод является одной из самых актуальных проблем.
Обзор литературы.
РАЦИОНАЛЬНОЕ ВОДОПОТРЕБЛЕНИЕ В ГАЛЬВАНИЧЕСКОМ ПРОИЗВОДСТВЕ. СТРУКТУРА ВОДОПОТРЕБЛЕНИЯ.
Вода в гальваническом производстве является необходимым компонентом практически всех операций, связанных с нанесением покрытий: подготовки поверхности, приготовления и корректировки электролитов, профилактики оборудования, мойкой готовых изделий и производственных площадей. Количество потребляемой воды зависит от мощности производства, вида наносимых покрытий, применяемого оборудования и эффективности использования воды. Основное количество воды приходится на промывные операции и профилактику оборудования.
Важным показателем расхода воды является ее количество, приходящееся на единицу площади покрываемых деталей.
ПРОМЫВКА.
Характерной чертой процессов гальванопокрытий является их многостадийность, причем отдельные виды обработки осуществляются в растворах различного состава и природы. Технологическим приемом, позволяющим предотвратить смешение рабочих растворов, а также удалить остатки растворов с поверхности деталей при их переходе в дальнейший передел, является меж- и послеоперационная промывка. От качества промывки во многом зависит качество гальванопокрытий. Например, при многослойных покрытиях возможно отслаивание, выход из строя ванн хромирования при заносе кислоты, нейтрализация ванн декапирования при заносе щелочи из ванн обезжиривания, коррозия готовых недостаточно промытых деталей. Поскольку электролиты представляют собой, в основном, водные растворы, то наиболее широкое распространение получила промывка водой.
Качество воды, идущей на промывку, регламентируется технологическим процессом, а также указывается в отраслевых регламентах. Жесткость воды предназначенной для приготовления электролитов, заполнения ванн улавливания, промывок перед нанесением покрытий и сушкой составляет до 1,5 мг*экв/дм3, а также солесодержание – до 80 мг/дм3. Поэтому вода перед использованием ее в гальванике должна пройти предварительную очистку. Так, для обычных покрытий используется питьевая вода, для специальных – деминерализованная.
Для снижения критерия промывки после основных процессов гальванопокрытий перед ваннами промывки устанавливают дополнительную ванну улавливания, содержимым которой периодически компенсируют потерю уровня воды рабочей ванны. Ванна улавливания обычно доливается свежей водой, либо водой следующей за ней ванной промывки. Использование такой ванны позволяет существенно сократить вынос компонентов электролитов в сточные воды. Концентрация примесей в ней значительно выше, чем в ваннах промывки, но ниже, чем в основной ванне.
Ванна улавливания представляет собой буферный объем для предварительного разбавления пленки электролита.
Концентрация электролита в ванне улавливания возрастает со временем и, в пределе, может оказаться равной концентрации в рабочей ванне. При этом будет сведено к минимуму ее свойство снижать коэффициент промывки. С точки зрения снижения расхода воды на промывку объем подпитки ванны улавливания должен быть максимальным.
Важное значение имеет концентрация электролита в ванне улавливания, поскольку для целей возврата электролита необходима максимальная концентрация, а для снижения расхода воды – минимальная. На практике концентрация электролита в ванне улавливания редко достигается 10 – 15 % от концентрации рабочей ванны. В общем случае установка ванн улавливания позволяет сократить расход промывной воды на 20 – 30 %. Это целесообразно делать там, где стоит задача возврата электролита, т.е. После основных ванн. После вспомогательных ванн (обезжиривания, декапирования), где основной задачей является сокращение количества промывных вод, предпочтительней системы из нескольких ванн.
Расход воды – один из основных факторов, влияющих на загрязнение окружающей среды и экономические показатели технологии гальванопокрытий. Задачей промывки является разбавление до нужной степени поверхностного слоя электролита.[23]
Очистка сточных вод от ионов тяжелых металлов.
Для практической реализации любого метода необходимо исследовать процесс обработки реальных промывных вод промышленных предприятий. Необходимо отметить, что в настоящее время не сформулирована четкая концепция обезвреживания сточных вод промышленных предприятий. Необходимо отметить, что в настоящее время не сформулирована четкая концепция обезвреживания жидких отходов гальванических производств (растворы, сточные воды), нет сравнительной технико-экономической оценки современных методов, типовых технологических схем, базового оборудования. Поэтому важной задачей является разработка различных технологических схем обработки промывных вод с учетом конкретного их состава и требований к степени очистки и качеству воды. Для более быстрого и эффективного использования данных технологий необходимо так же разработать новые конструкции аппаратов. [8,20]
Сточные воды после обезвреживания хроматов, а также кислотно-щелочные стоки должны быть очищены от ионов тяжелых металлов (никеля, цинка, хрома, меди и др.). Традиционно воду от соединений тяжелых металлов очищают путем перевода их в нерастворимые в воде соединения, которые затем удаляют отстаиванием, флотацией, фильтрацией и др. способами разделения твердой и жидкой фаз. Перевод в твердую фазу в основном осуществляют введением щелочи с образованием гидроксидов, гидроксокарбонатов, карбонатов, а также сульфидных ионов, что приводит к образованию водонерастворимых сульфидов тяжелых металлов.
На результаты очистки сточных вод существенное влияние оказывают происхождения стоков, исходная концентрация загрязнителей, рН, наличие комплексообразователей, ионная сила раствора, природа щелочного реагента, а также особенности технологии коагуляции, флуктуации и разделения осадков и жидкой фазы.
С увеличением рН растворимость гидроксидов тяжелых металлов уменьшается, достигает минимума и затем возрастает. При высоких значениях рН некоторые гидроксиды амфотерных металлов (цинк, хром) легко образуют растворимые гидрокомплексы при небольшом избытке щелочи.
Гидроксиды тяжелых металлов оказывают взаимное влияние на полноту очистки смешанных сточных вод. Присутствие ионов хрома(3) при очистке цинкосодержащих сточных вод снижает растворимость гидроксида цинка и его содержание в исходной воде проявляется в меньшей мере. [23]
Но основными проблемами, которые возникают сегодня при очистке стоков гальванотехники от соединений хрома, являются : обезвреживание хрома (6) до ПДК (0,005-0,01 мг/л); минимальные расходы реагента и электроэнергии при восстановлении; эффективное удаление дисперсной фазы Cr(ОН)3 до концентрации 0,1-,05 мг/л. Важной задачей является так же сокращение расхода реагента-восстановителя [27].
Очистка сточных вод от ионов хрома.
Источники поступления соединений хрома в сточные воды.
Сточные воды гальванического производства составляют от 30 до 50% общего количества сточных вод, которые образуются на предприятиях. Средний объем гальванических сочных вод, образующихся на одном гальваническом производстве, составляет 600-800 м3/сутки. Гальваническое производство относится к числу наиболее неэкономичных, отличается вредными условиями труда, большим количеством отходов. Ежегодно сбрасывается до 1 км3 токсичных сточных вод, содержащих до 50 тыс. тонн тяжелых металлов, 25-30% этих сточных вод попадает в водные бассейны.
В результате экономический ущерб, причиняемый гальваникой народному хозяйству, оценивается в 2 млр. рублей в ценах 1990 года [1].
Отходы в гальванотехнике образуются вследствие выноса высококонцентрированных (порядка 100г/л) растворов. С отходами тесно связана и проблема обезвреживания – очистки двух вспомогательных потоков: промывной воды (2 м3/м2) и воздуха (100 м3/м2). Необходимость применения воды и воздуха в таких значительных количествах связана с несовершенством применяемого оборудования [1-2].
Сточные воды гальванического производства часто содержат в своем составе соединения трех- и шестивалентного хрома [1-2].
Источником поступления Cr (VI) служат промывные воды ванн хромирования, хроматирования, травления меди и латуни, анодирование алюминия [2,3]. Соединения Cr (III) реже встречаются в промывных водах гальванотехники и в основном являются продуктом восстановления Cr (VI) ионами Fe (II), органическими восстановителями или при травлении меди. В последнее время в практику хромирования стали внедрять электролиты на основе соединений Cr (III) [4,5].
Проведенные эксперименты и исследования показывают, что даже при незначительной толщине покрытия деталей средней сложности, количество материала, выносимое из гальванической ванны в проточно-промывные воды, в несколько раз превышает расход металла на покрытие.
Ежегодно при промывке изделий теряется более 3,3 тыс. тонн цинка, 2,4 тыс. тонн никеля, 0,5 тыс. тонн хрома и ограниченное количество воды – 3,2 км3/год [3].
Приведенные данные показывают, что сточные воды гальванического производства, содержащие ионы тяжелых металлов, наносят огромный экономический и экологический ущерб. Он связан с потерей дефицитных материалов и разрушением окружающей среды и здоровья человека.
Основной задачей обезвреживания сточных вод, содержащих соединения хрома(6), является восстановление до трехвалентного состояния. Соединения хрома(3) более чем в 100 раз менее токсичны и склонны к гидролизу в щелочной среде, что позволяет удалять их в виде гидроксида при последующей очистке.
Известные способы восстановления хрома(6) можно условно подразделить на протекающие в жидкой фазе (в кислотной, щелочной и нейтральной средах) и гетерофазные (восстановительные, сорбционно-восстановительные и электрохимические).
Ход реакции восстановления хрома в кислой среде зависит от исходной концентрации хрома(6), величины рН, температуры. Эти параметры влияют на полноту восстановления и необходимую величину избытка восстановителя. Присутствие ионов железа, кадмия, цинка вдвое замедляет процесс.
Восстановление хрома в кислой среде можно осуществлять при любых объемных расходах воды в довольно широком диапазоне концентраций.[23]
Современные методы очистки сточных вод от ионов хрома.
Из анализа литературы следует, что перспективными способами решения указанных задач в нашей стране могут стать электрохимические методы и, в частности, электрофлотация с нерастворимыми электродами, электрокоррекция рН, мембранный метод, электродиализ и электролиз. Несмотря на то, что электрофлотация известна в нашей стране с 70-х годов, ее использование для решения экологических проблем гальванотехники ранее не приводилось. В тоже время этот метод является достаточно универсальным, высокоэффективным, экологически безопасным и достаточно экономичным. [8, 20]
Проблема с осаждения ионов тяжелых и цветных металлов заключается в том, что оптимальное значение рН для различных ионов не одинаково.
Так, например, для ионов Fe(III), Cr(III), Al(III) оптимальным является рН=6-7; для Сu(II), Zn(II), - рН=9,0-9,5; для Ni(II) и Cd(II) рН=10-10,5. Для повышения степени извлечения тяжелых металлов применяют различные флокулянты, осадители и коагулянты [9].
Использование новых физико-химических методов очистки в сочетании с реагентным позволяют решить проблему снижения содержания ионов тяжелых металлов в сточных водах до 0,01-0,05 мг/л с одновременной утилизацией отходов. Наиболее доступные на сегодняшний день – электрохимические.
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ ОЧИСТКИ ВОД.
К физико-химическим методам очистки сточных вод относят флотацию, адсорбцию, ионный обмен, экстракцию, выпаривание, дистилляцию и др. Эти методы используют для удаления из сточных вод тонкодиспергированных взвешенных частиц (твердых и жидких), растворимых газов, минеральных и органических веществ.
Использование физико-химических методов для очистки сточных вод по сравнению с использованием биохимических методов имеет ряд преимуществ: 1) возможность удаления из сточных вод токсичных, биохимически неокисляемых органических загрязнений; 2) достижение более глубокой и стабильной степени очистки; 3) уменьшение размеров сооружений; 4) уменьшение чувствительности к изменениям нагрузок; 5) возможность полной автоматизации; 6) более глубокая изученность кинетики ряда процессов, а так же вопросов моделирования, математического описания и оптимизации, что важно для правильного выбора и расчета аппаратуры; 7) отсутствие контроля за деятельностью живых организмов; 8) возможность рекуперации различных веществ.[1]
ФЛОТАЦИЯ.
Флотацию применяют для удаления из сточных вод нерастворимых диспергированных примесей, которые самопроизвольно плохо отстаиваются. В некоторых случаях флотацию используют и для удаления растворенных веществ, например, пав. Такой процесс называют «пенной сепарацией» или «пенным концентрированием». Флотацию применяют для очистки сточных вод многих производств. Она используется также для выделения активного или после биохимической очистки.
Достоинствами флотации являются непрерывность процесса, широкий диапазон применения, небольшие капитальные и эксплуатационные затраты, простая аппаратура, селективность выделения примесей, по сравнению с отстаиванием большая скорость процесса, а так же возможность получения шлама более низкой влажности (90-95%), высокая степень очистки (95-98%), возможность рекуперации удаляемых веществ. Флотация сопровождается аэрацией сточных вод, снижением концентрации пав и легкоокисляемых веществ, бактерий и микроорганизмов. Все это способствует успешному проведению последующих стадий очистки сточных вод.
Элементарный акт флотации заключается в следующем: при сближении подымающегося в воде пузырька воздуха с твердой гидрофобной частицей разделяющая их прослойка воды при некотором критической толщине прорывается и происходит слипание пузырька с частицей. Затем комплекс пузырек – частица подымается на поверхность воды, где пузырьки собираются и возникает пенный слой с более высокой концентрацией частиц, чем в исходной воде.
Вероятность прилипания зависит от смачиваемости частицы, которая характеризуется величиной краевого угла θ. Чем больше краевой угол смачивания, тем больше вероятность прилипания и прочность удержания пузырька на поверхности частицы. Прилипание происходит при столкновении пузырька с частицей или при возникновении пузырька из раствора на поверхности частицы. На величину смачиваемости поверхности взвешенных частиц влияют адсорбционные явления и присутствие в воде примесей пав, электролитов и др.
Пав – реагенты-собиратели, адсорбируясь на частицах, понижают их смачиваемость, т.е. Делают их гидрофобными. В качестве реагентов-собирателей используют: масла, жирные кислоты и их соли, амины и др. Повышения гидрофобности частиц можно достичь и сорбцией молекул растворенных газов на их поверхности.
Эффект разделения флотацией зависит от размера и количества пузырьков воздуха. По некоторым данным оптимальный размер пузырьков =15-30 мкм. При этом необходима высокая степень насыщения воды пузырьками, или большое газосодержание. Удельный расход воздуха снижается с повышением концентрации примесей, так как увеличивается вероятность столкновения и прилипания. Большое значение имеет стабилизация размеров пузырьков в процессе флотации. Для этой цели вводят различные пенообразователи, которые уменьшают поверхностную энергию раздела фаз. Некоторые из этих веществ обладают собирательными и пенообразующими свойствами.
Вес частиц не должен превышать силы прилипания ее к пузырьку и подъемной силы пузырьков. Размер частиц, которые хорошо флотируются, зависит от плотности материала и =0,2-1,5 мм.
Различают следующие способы флотационной обработки сточных вод: с выделением воздуха из растворов; с механическим диспергированием воздуха; с подачей воздуха через пористые материалы, электрофлотацию и химическую флотацию. [7]
Электрохимические методы очистки сточных вод.
Электохимические методы имеют ряд преимуществ перед химическими способами: 1) упрощение технологической схемы и эксплуатации технологических установок, легкая автоматизация их работы, уменьшение производственных площадей, необходимых для размещения очистных сооружений; 2) возможность обработки сточных вод без предварительного разбавления; 3) снижение солесодержания стоков и уменьшение количества осадков при обработке [10].
Из электрохимических методов очистки сточных вод гальванического производства наибольшее распространение получил электрокоагуляционный метод, применяемый для очистки от взвешенных частиц и коллоидно-дисперсных систем, ионов цветных металлов, и особенно хрома. В процессе электрокоагуляции происходит растворение аллюминевых или железных анодов, сопровождающееся подщелачиванием раствора, приводящим к образованию оксидов металлов, при этом гидроксиды железа и аллюминия выступают в качестве коагулянтов. Метод электрокоагуляции имеет ряд достоинств: компактность установки, отсутствие необходимости в реагентах – восстановителях и осадителях, простота обслуживания и универсальность[11]. Сдерживающим фактором в его развитии является большой расход металла и электроэнергии.
Наряду с электрокоагуляцией, широкое распространение получил электрофлотокоагуляционный метод очистки сточных вод, который сочетает два метода – электрокоагуляционную обработку и электрофлотацию полученных гидроксидов металлов. Данный процесс может быть осуществлен в одном электролизере: при растворении анода происходит образование коагулянта, а на катоде выделяются высокодисперсные пузырьки водорода, обеспечивающие флотацию продуктов коагуляции [12].
Среди электрохимических методов особое место занимает электрофлотация – физико-химический процесс, сочетающий в себе такие электрохимические методы, как электродиализ, электрофорез, электрохимическое окисление-восстановлене. Являясь по своей физической сущности электрохимическим и гидромеханическим процессом, электрофлотация выгодно отличается от традиционных методов благодаря высокой эффективности и простоте аппаратурно-технологического процесса [13,14]. Например, процесс разделения ускоряется по сравнению с методом отстаивания в 5-10раз [15].
Электрохимические методы являются достаточно эффективными для восстановления шестивалентного хрома. Установлено, что электрохимический метод применим лишь в том случае, если электролит содержит в качестве активатора не менее 1% ионов хлора, так как при отсутствии его железные аноды пассивируются и электрохимическое восстановление не происходит [16]. Для предприятий, сточные воды которых содержат ионы тяжелых металлов и расход этих вод составляет 5-50м3 в сутки, использование электрохимических методов очистки экономически выгоднее по сравнению с реагентными. Применение электрохимических методов, в том числе электрохимическое регулирование рН, в отличие от реагентных методов, позволяет без дополнительного обессоливания очищенной воды создать замкнутую схему водопользования.[12, 15, 20]
ЭЛЕКТРОФЛОТАЦИЯ.
В этом процессе очистка сточных вод от взвешенных частиц проходит при помощи пузырьков газа, образующихся при электролизе воды. На аноде возникают пузырьки кислорода, а на катоде – водорода. Поднимаясь в сточной воде, эти пузырьки флотируют взвешенные частицы.
При использовании растворимых электродов происходит образование хлопьев коагулянтов и пузырьков газа, что способствует более эффективной флотации.
Основную роль при электрофлотации играют пузырьки, образующиеся на катоде. Размер пузырьков водорода значительно меньше, чем при других методах флотации. Он зависит от краевого угла смачивания и кривизны поверхности электродов. Диаметр пузырьков меняется от 20 до 100 мкм. Мелкие пузырьки обладают большей растворимостью, чем крупные. Из пересыщенных растворов мельчайшие пузырьки выделяются на поверхности частичек загрязнений и тем самым способствует эффекту флотации.
Следовательно, при электрофлотации извлечение загрязнений происходит в результате прилипания к частицам подымающихся в воде пузырьков, а также образования на поверхности частичек пузырьков из пересыщенного раствора. Для получения пузырьков требуемого размера необходим правильный подбор материала, диаметра проволоки катода и плотности тока. Оптимальное значение плотности тока 200-260 А/м2, величина газосодержания – около 0,1%.
При небольших объемах сточных вод (10-15 м3/ч) электрофлотационные установки могут быть однокамерные, при больших – следует применять двухкамерные установки, которые могут быть горизонтальными или вертикальными. Они состоят из электродного отделения и отстойной части. [15]
электрофлотационный метод извлечения ионов металлов из стоков гальванопроизводств.
Большинство используемых методов для обезвреживания сточных вод основано на превращении вредных веществ в безвредные, но не на утилизацию. Метод, применяемый на предприятиях в целях очистки сточных и промывных вод, позволяющий эффективно извлекать ионы тяжелых металлов в виде гидроксидов и оксидов является электрофлотацией с нерастворимыми анодами.
Высокая эффективность электрофлотационного процесса по сравнению с обычными методами флотации объясняется малыми размерами пузырьков, радиус которых составляет 5,30 мкм. Большое значение играет так же значительный заряд поверхности пузырьков, затрудняющий коагуляцию.
ЭЛЕКТРОФЛОТАЦИОННЫЕ УСТАНОВКИ
В электрофлотационных установках для проведения процесса флотации используют газообразные продукты — водород и кислород, выделяющиеся на электродах при электролизе обрабатываемой воды. На катоде происходит разряд молекул воды с образованием водорода:
2Н2О + 2е → Н2 + 2НО-
На аноде процесс окисления сопровождается выделением кислорода:
2Н2О → О2 + 4Н++ 4е
Размер пузырьков газа определяется природой и формой электродов, а также условиями проведения электролиза (плотностью тока, температурой и др.). Принципиально электролиз позволяет получить заранее заданное распределение пузырьков газа по размерам. Электролитическое диспергирование газа обеспечивает также получение наиболее высокодисперсной газовой фазы, что позволяет использовать электрофлотаторы для очистки воды от устойчивых коллоидных загрязнителей.
Электрофлотационные установки разделяют по направлению движения воды и флотирующих газов в них на противоточные и прямоточные с горизонтальным или вертикальным расположением электродов. Электрофлотационные аппараты имеют одну или несколько камер. Многокамерный электрофлотатор состоит обычно из успокоителя, электродных камер и флотоотстойника. Сточная вода поступает в приемную камеру, отделенную от основной части перегородкой. Электродный блок представляет собой набор катодов и анодов. Проходя через электроды, вода насыщается газообразными продуктами реакции, что приводит к всплыванию частиц.
Электроды выполняют в виде пластин, однако чаще применяют их в виде проволочной сетки из меди или нержавеющей стали. Размер пузырьков газа, покидающих электроды, зависит от величины краевого угла смачивания и кривизны поверхности электродов, поэтому, изменяя диаметр проволоки, удается регулировать дисперсность газовой фазы. Оптимального распределения по размерам газовых пузырьков, а также газонаполнения достигают варьированием плотности тока на электродах.
При горизонтальном расположении электродов во флотационной камере на них могут оседать твердые частицы, которые нарушают нормальную работу аппарата. Имеются конструкции, позволяющие избавиться от указанного недостатка. Например, электрофлотатор, в котором аноды выполнены в форме трехгранных призм, расположенных в шахматном порядке на дне аппарата. Катоды представляют собой отдельные проволочные сетки, изогнутые под углом и расположенные над анодами параллельно граням.
Очищаемая вода поступает в приемную камеру 7, откуда переливается во флотационную камеру, в которой насыщается пузырьками газа. Пузырьки газа флотируют загрязняющие компоненты на поверхность, где частицы скапливаются в виде пены, которая удаляется по наклонному желобу. Внутри желоба проходит трубопровод с горячей водой. Пенообразная масса в результате нагрева частиц гаснет и стекает в сборник. Освобожденная от взвешенных частиц вода переливается в камеру и удаляется из аппарата. Частицы, которые тяжелее воды, опускаются вниз и выводятся через штуцер.
Недостатком рассмотренных конструкций является возможность образования в процессе электролиза взрывоопасной смеси газов—2/3 водорода и 1/3 кислорода. Известны конструкции флотаторов, в которых анодное пространство отделяется от катодного диафрагмой, препятствующей смешению газов. В качестве материала для диафрагмы используют хлорированные или асбестовые ткани, которые пропитывают смолами для уменьшения их пористости.
Количество газа, генерируемого в электрофлотаторе, можно определить из выражения
V0=![]()
где V -
объем газа, выделяющегося при нормальных условиях (м3); ![]() - количество газа (м3),
выделяющегося при прохождении 1 кА∙ч (электрохимический эквивалент); I - сила тока, проходящего через
аппарат (кА); τ - время обработки, ч; ВT
— коэффициент использования тока, доли единицы; п - число пар
электродов;
- количество газа (м3),
выделяющегося при прохождении 1 кА∙ч (электрохимический эквивалент); I - сила тока, проходящего через
аппарат (кА); τ - время обработки, ч; ВT
— коэффициент использования тока, доли единицы; п - число пар
электродов; ![]() =0,418 мз/(кА∙ч).
=0,418 мз/(кА∙ч).
Объем влажного газа в реальных условиях определяют из уравнения
![]()
где W - парциальное давление насыщенных водяных паров при 20°С, равное 2,3 кПа; В—давление в системе, кПа; Р - атмосферное давление, кПа; 101,3 - давление при нормальных условиях, кПа. [25]
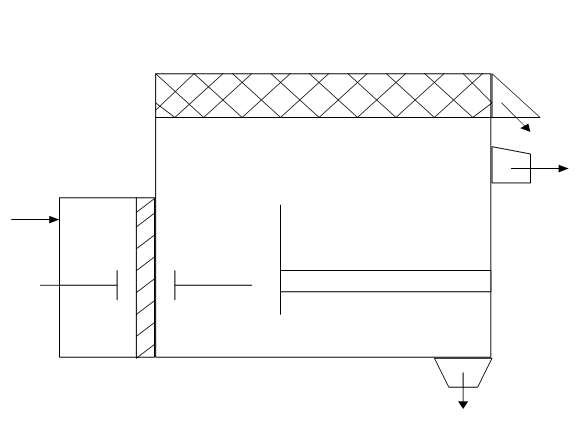
Схема электрофлотатора.
Сточная вода поступает по трубопроводу 1 в анодную приемную камеру 2, отделенную от основной 4 перегородкой 3, затем через перегородку 3 в катодную камеру 4. Проходя через электроды, вода насыщается газообразными продуктами реакций, что приводит к всплыванию частиц. Электроды выполнены в виде пластин. Пена с загрязняющими частицами 5 сливается через наклонный желоб 6. Освобожденная от взвешенных частиц вода удаляется через трубу 7. Частицы, которые тяжелее воды, опускаются вниз и выводятся через штуцер 8.
Физико-химические аспекты электрофлотации.
Флотация – процесс, основанный на слиянии отдельных частиц вещества под действием молекулярных сил с пузырьками тонкодиспергированного в воде газа или газов, всплывании образующихся при этом агрегатов и образовании на поверхности флотатора пены. Флотируемость частиц зависит от размеров пузырьков газа, которые определяются поверхностным натяжением на границе газ-вода. С понижением поверхностного натяжения эффективность очистки сточных вод флотацией повышается в отличие от отстаивания и фильтрования. При предварительном коагулировании примесей воды эффект флотации повышается [20,21].
При флотации в жидкости происходят ряд процессов: растворение воздуха, прикрепление воздушных пузырьков к частицам взвеси и всплывание их на поверхность с образованием пены.
Для успешного протекания процесса необходимо, чтобы твердые частицы и пузырьки воздуха прочно прикреплялись друг к другу. При флотации сточных вод пена должна быть достаточно прочной и не допускать обратного попадания загрязнений в воду.
Важной стадией электрофлотационного процесса является также адгезия газовых пузырьков частиц загрязнений, которая происходит на молекулярном уровне.
Выводы из литературного обзора.
Из анализа литературы можно сделать следующие выводы.
1. Большой цикл работ выполнен по электрофлотации-коагуляции с растворимыми анодами, что обеспечивает достаточно высокую степень очистки, но не позволяет регенерировать металлы из промывных вод, организовывать водооборот и характеризуется высокими энергозатратами.
2. Из обзора научной литературы следует, что индивидуально, без специальных добавок Сr (III) и Cr (VI) электрофлотационным методом практически не извлекаются.
На основании результатов исследований разработать технологию очистки сточных вод гальванического производства от соединений хрома.
выбор и обоснование электрофлотационного способа обезвреживания сточных вод.
Электрофлотационный метод извлечения ионов металлов из стоков гальванопроизводств.
Большинство используемых методов для обезвреживания сточных вод основано на превращении вредных веществ в безвредные, но не на утилизацию. Метод, применяемый на предприятиях в целях очистки сточных и промывных вод, позволяющий эффективно извлекать ионы тяжелых металлов в виде гидроксидов и оксидов является электрофлотацией с нерастворенными анодами. Флотационный процесс основан на адгезии загрязнений на поверхности электрохимически генерируемого пузырька. Плотность образовавшихся флотокомплексов меньше плотности раствора, поэтому они поднимаются в верхнюю часть аппарата с образованием устойчивого пенного слоя. Электрофлотационный метод обеспечивает извлечение только нерастворимых соединений металлов[22].
Высокая эффективность электрофлотационного процесса по сравнению с обычными методами флотации объясняется малыми размерами пузырьков, радиус которых составляет 5-30 мкм. Большое значение играет также значительный заряд поверхности пузырьков, затрудняющих их коагуляцию. Поверхностный заряд обусловлен адсорбцией ионов Н+ или ОН- в приэлектродной зоне и имеет положительный знак для газов, выделяющихся на аноде и отрицательный – на катоде. Поверхность же большинства гидроксидов металлов заряжена положительно, что обеспечивает эффективный захват частицы пузырьками водорода. Действительно, в катодной камере корректора эффективность коалесценции пузырьков водорода мала и составляет 0,001-0,008. При этом эффективность очистки находится в пределах 90-95%. В электрофлотационной камере происходит одновременное выделение кислорода и водорода, которые эффективно коаллесцируют друг с другом. Экспериментальные результаты свидетельствуют, что флотация гидроксидов металлов только пузырьками кислорода неэффективна. В то же время скорость электрофлотационного извлечения смесью пузырьков водорода и кислорода неаддитивно больше скорости флотации только пузырьками водорода, что может объясняться взаимодействием пузырька кислорода с флотокомплексом частица-пузырек водорода. В присутствии пузырьков кислорода увеличивается стесненность движения пузырьков водорода, что приводит к увеличению времени их пребывания в аппарате и интенсификации процесса.
Рассмотрим для сравнения классические схемы очистки сточных вод:
Ионный обмен.
Метод ионного обмена является одним из способов извлечения металлов из промывных вод в локальных циклах, позволяющих создать малоотходное производство. Он основан на обмене между ионами, находящимися в растворе и ионами, присутствующими на поверхности ионообменной смолы. Ионный обмен находит широкое практическое применение в технологиях очистки промывных вод ведущих зарубежных фирм ФРГ, Японии, США.
К достоинствам ионного обмена следует отнести высокую эффективность очистки, высокую концентрирующую способность по металлу (в 1000 - 10000 раз), возможность получения извлеченных металлов в виде однокомпонентных растворов солей, простое аппаратурное оформление. Недостатки метода ионного обмена связаны с наличием стадии регенерации ионитов. Использование ионообменной технологии целесообразно при содержании металлов в сточной воде в концентрациях до 1 мг/л. Указанный метод позволяет регенерировать соединения шестивалентного хрома, снизить расходы на очистку воды и переработку осадка.
Анализ отечественной и зарубежной литературы показывает, что в процессах ионообменной очистки сточных вод от хрома (VI) широкое применение нашли иониты на основе сополимера с дивинилбензолом, содержащие группы триметиламина. Однако, существенным недостатком ионитов типа АВ является малая химическая, гидролитическая и термическая устойчивость. Более перспективными сорбентами для целей извлечения хрома из природных и сточных вод, при строго контролируемом составе вод после очистки и повышенной температуре, являются низкоосновные аниониты [17, 18].
Разработана рациональная технология ионообменной очистки кислых хромосодержащих сточных вод травильных отделений ГПЗ-2 от Cr(VI) и сопутствующих примесей с замкнутым водооборотом и утилизацией высокотоксического хрома (VI). Благодаря применению высокоселективных химически и гидролитически стойких пиридиносодержащих сорбентов удается очистить промышленные стоки до требуемых пределов и вернуть его в оборот для нужд производства. Данная технология не наносит вред экологии – с ее помощью удается не только предотвратить загрязнение водоемов токсичными продуктами, но эта технология позволяет существенно сократить расход потребляемой воды (на 80%) в условиях ее дефицита в г. Москве [19].
Реагентная очистка сточных вод от шестивалентного хрома
Соединения шестивалентного хрома - хромовая кислота и ее соли применяются при нанесении хромовых покрытий, при химической обработке (травление, пассивирование), при электрохимической обработке (анодирование), при электрополировке стальных изделий.
Сточные воды обрабатываются в две стадии: 1) восстановление шестивалентного хрома до трехвалентного; 2) осаждение трехвалентного хрома в виде гидроксида.
В качестве реагентов-восстановителей наибольшее применение получили натриевые соли сернистой кислоты - сульфит Na2SO3), бисульфит NaHSO3), пиросульфит (Na2S2O5), а также дитионит натрия (Na2S2O4). Восстановление Сг6+ до Сг3+ происходит по реакциям:
восстановление сульфитом натрия
Сr2О72- + 3S032- + 8Н+ → 2Сr3+ + 3S042- + 4Н20
восстановление бисульфитом натрия
Сr2О72- + 3HS03- + 5Н+ → 2Сr3+ + 3S042- + 4Н20
восстановление пиросульфитом натрия
2Сr2О72- + 3S2052- + 10Н+ → 4Сr3+ + 6S042- + 5Н20
восстановление дитионитом натрия
Сr2О72- + 3S2042- + 6Н+ → 2Сr3+ + 2S042- + 3Н20
Теоретические дозы реагентов-восстановителей составляют (мг/1мг Сг6+): для сульфита 3,63, бисульфита 3,0, пиросульфита 2,88, дитионита натрия 1,67.
Соли сернистой кислоты добавляют к сточным водам в виде 10 %-ных водных растворов. Доза восстановителя зависит от исходной концентрации Сг3+ в сточной воде и величины рН. Скорость и полнота реакций восстановления Сг6+ до Сг3+ в большой степени также зависят от величины рН реакционной смеси. Наибольшая скорость реакций восстановления достигается в кислой среде при рН=2-2,5, что обычно требует дополнительного подкисления сточных вод 10-15%-ным раствором серной кислоты (возможно использование растворов других минеральных кислот). В табл. приведены удельные расходы натриевых солей сернистой кислоты, необходимые для восстановления одной весовой части шестивалентного хрома при обработке сточных вод с различной исходной концентрацией Сг6+ и различной величиной рН.
Передозирование восстановителя недопустимо; перерасход реагента даже на 10% приводит к образованию комплексных солей трехвалентного хрома и серной кислоты, которые не полностью разрушаются при последующей нейтрализации сточных вод.
В качестве реагентов-восстановителей можно также использовать отходы металлического железа (в виде стальной стружки, скрапа и т.п.), или сульфат двухвалентного железа. В первом случае подкисленные до рН 2 сточные воды фильтруют через находящийся в реакторе слой железной стружки при постоянном барботировании воздухом. Во втором случае раствор сульфата железа (в виде 10%-ного водного раствора) вводят в реактор, в который поступают сточные воды. В отличие от солей сернистой кислоты восстановление Сr6+ до Сг3+ солями двухвалентного железа протекает с достаточно высокой скоростью не только в кислой, но и в нейтральной и щелочной средах по реакциям:
Сr2О72- + 6Fe2+ + 14Н+ → 2Сr3+ + 6Fe2+ + 7Н20
Сr2О72- + 3Fe(OH)2 + 4Н2O → 4Сr(OH)3↓ + 3Fe(OH)3↓ + 2OН-
Поэтому в случае применения сульфата железа (II) в качестве реагента-восстановителя предварительное подкисление сточных вод не требуется, а для полного восстановления Сг6+ до Сг3+ необходим лишь незначительный избыток реагента (около 5 % от стехиометрического количества) независимо от исходной концентрации Сг6+ в сточных водах и величины рН. Недостатком использования сульфата железа, а также железосодержащей суспензией по методу ферритизации, в качестве реагентов-восстановителей по сравнению с солями сернистой кислоты является более чем 4-кратное увеличение объема образующихся при последующей нейтрализации твердых осадков, поскольку на 1 массовую часть осадка гидроокиси хрома дополнительно образуется 3,12 массовых частей осадка гидроксида железа (III).
В качестве реагентов для восстановления Сг6+ до Сг3+ можно также применять пероксид водорода (в кислой среде), сернистый газ, гидразин (в нейтральной или слабощелочной среде).
Таблица
Необходимые дозы (мг на 1 мг Сr3+) сульфита натрия (А), бисульфита натрия (Б), пиросульфита и дитионита натрия (В) при обработке сточных вод, содержащих соединения шестивалентного хрома
|
Концентрация мг/л |
рН1 | рН2 | рНЗ | рН4 | |||||||||||||
| Сr(VI), |
A |
Б |
B |
A |
Б |
B |
A |
Б |
B |
A |
Б |
B |
|
|||||
|
10 | 15 8,0 4,4 | 20 9,0 5,0 | 25 9,3 5,2 | 40 10,6 5,9 | |||||||||||||
|
20 | 10 6,5 3,6 | 16 8,0 4,4 | 20 8,4 4,7 | 25 9,3 5,2 | |||||||||||||
|
30 | 9 6,25 3,47 | 13 7,75 4,3 | 16 8,25 4,6 | 20 8,85 4,9 | |||||||||||||
|
40 | 8 6,1 3,4 | 9 7,2 4,0 | 13 8,0 4,4 | 16 8,5 4,7 | |||||||||||||
|
50 | 7,5 5,7 3,16 | 8,2 6,95 3,9 | 9,5 7,5 4,16 | 11,5 8,2 4,55 | |||||||||||||
|
60 | 7,25 5,5 3,1 | 7,9 6,5 3,6 | 9,3 7,3 4,05 | 10,3 8,0 4,4 | |||||||||||||
|
75 | 7,0 5,25 2,92 | 7,5 6,15 3,42 | 8,0 6,9 3,8 | 9,0 7,6 4,2 | |||||||||||||
|
80 | 6,7 5,2 2,9 | 7,1 6,2 3,4 | 7,8 7,0 3,9 | 8,7 7,4 4,1 | |||||||||||||
|
100 | 6,5 5,0 2,8 | 6,7 5,6 3,1 | 7,3 6,5 3,6 | 8,0 7,2 4,0 | |||||||||||||
|
150 | 6,0 4,5 2,5 | 6,2 5,2 2,9 | 6,7 5,8 3,2 | 7,3 6,55 3,6 | |||||||||||||
|
200 | 5,5 4,0 2,2 | 5,8 5,0 2,8 | 6,3 5,5 3,05 | 6,8 6,2 3,44 | |||||||||||||
|
250 | 5,25 4,0 2,2 | 5,6 5,0 2,8 | 6,0 5,45 3,03 | 6,6 6,15 3,42 | |||||||||||||
|
300 | 5,0 4,0 2,2 | 5,4 5,0 2,8 | 5,8 5,4 3,0 | 6,4 6,1 3,39 | |||||||||||||
|
400 | 4,8 4,0 2,2 | 5,3 4,6 2,55 | 5,6 5,35 2,97 | 6,1 6,0 3,33 | |||||||||||||
|
500 | 4,7 4,0 2,2 | 5,2 4,5 2,5 | 5,5 5,3 2,94 | 6,0 5,6 3,1 | |||||||||||||
|
600 | 4,5 4,0 2,2 | 5,2 4,45 2,47 | 5,5 5,3 2,94 | 6,0 5,55 3,08 | |||||||||||||
При обработке хромсодержащих сточных вод на установках периодического действия рекомендуется использовать два реактора, причем полезный объем каждого из реакторов следует принимать равным расчетному часовому расходу сточных вод. При обработке стоков на установках непрерывного действия полезную емкость реактора рекомендуется принимать равной 30-ти минутному расчетному расходу.
После окончания реакции восстановления Сг6+ в кислой среде сточные воды подвергают нейтрализации с целью осаждения Сг3+ в виде гидроксида по реакции
Сr3+ + ЗОН-→ Сr(ОН)3↓.
На установках непрерывного действия нейтрализацию кислых вод, содержащих Сг3+, проводят после их предварительного смешивания с другими кислыми и щелочными сточными водами гальванопроизводства.
На установках периодического действия иногда хромсодержащие сточные воды нейтрализуют отдельно от сточных вод других видов. Для нейтрализации обычно используют известковое молоко, в более редких случаях - соду и едкий натрий. Оптимальная величина рН для осаждения Сr(ОН)3 составляет 8,5-9, при выходе за эти пределы растворимость Сг(ОН)з увеличивается и, как следствие, ухудшается полнота извлечения гидроокиси хрома из сточных вод. При рН >12 амфотерная гидроокись Сг3+ в избытке щелочи образует растворимые хромиты:
Сr(ОН)3 + ЗNаОН →Nа3[Сr(ОН)6],
или
Сr(ОН)3 + 3ОН-→ [Сr(ОН)6]3-.
Принципиальная схема очистки хромсодержащих сточных вод с начальной концентрацией ионов хрома (VI) до 600 мг/л реагентным методом представлена на рисунке.
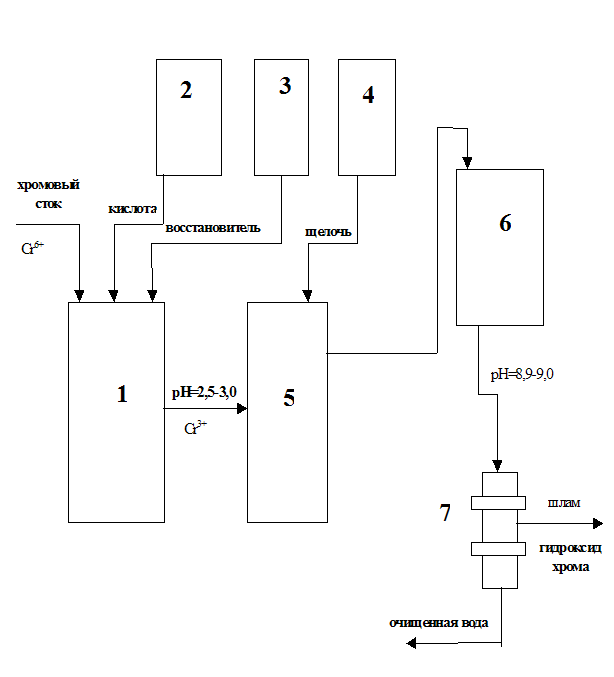
Принципиальная схема очистки хромсодержащих сточных вод реагентным методом: 1 - реактор-накопитель хромовых стоков,
2 -дозатор кислоты, 3 - дозатор восстановителя, 4 - дозатор щелочи,
5 - реактор-нейтрализатор, 6 - отстойник, 7 - механический фильтр. [26]
ВЫВОД.
Вышеуказанные способы реагентной очистки позволяют извлекать ионы тяжелых металлов, в частности, хрома. Вместе с тем имеется ряд причин, не позволяющих эффективно использовать реагентный метод:
· низкий уровень автоматизации;
· недостаточное время пребывания сточной воды в отстойнике из-за большого объема стоков и превышения проектной мощности очистных сооружений;
· невысокое значение степени очистки.
Кроме того, для реагентного осаждения существенным недостатком является большой расход реагентов.
Метод, применяемый на предприятиях в целях очистки сточных и промывных вод, позволяющий эффективно извлекать ионы тяжелых металлов в виде гидроксидов и оксидов является электрофлотацией с нерастворенными анодами. Являясь по своей физической сущности электрохимическим и гидромеханическим процессом, электрофлотация выгодно отличается от традиционных методов благодаря высокой эффективности и простоте аппаратурно-технологического процесса. Например, процесс разделения ускоряется по сравнению с методом отстаивания в 5-10раз.
Электрофлотационный способ очистки гораздо дешевле реагентного, т.к. реактивы дорогие. Финансовые затраты требуются только на потребление электричества. Так же он протекает намного быстрее отстаивания. Имеет более высокую степень очистки. Так как при флотации в жидкости происходят ряд процессов: растворение воздуха, прикрепление воздушных пузырьков к частицам взвеси и всплывание их на поверхность с образованием пены.
Не требует механических фильтров и дальнейшей обработки. Занимает гораздо меньше полезной площади. Имеет меньшее количество стадий очистки. Способен извлекать одновременно сразу все загрязняющие вещества.
экспериментальная часть.
Цель:
1. Разработка замкнутой системы водообеспечения и водооборота при очистке от Сr3+.
2. Определение возможности использования электрофлотатора для разделения осадка хрома в промывных водах гальванического цеха.
3. Исследование влияния, присутствующих в водах компонентов, органических и неорганических, на анодный и катодный процессы генерации флотирующего агента на окисно-рутениевом титановом аноде и катоде из нержавеющей стали.
Задача исследования:
1. Определение воздействия присутствующих в сточной воде компонентов на вольт-амперные характеристики катодных и анодных процессов.
2. Оценка величины поляризации электродных материалов при рабочих плотностях тока в электрофлотаторе.
Эти исследования выполняются методом вольт-амперных характеристик (потенциодинамическим методом).
Для снятия кривых используется потенциостат П-54.
Исследования проводятся на 3х электродной схеме. Скорость задания потенциала 5mВ/с В (стационарная кривая) .
Исследуются компоненты, которые характерны для данного производства, и возможно их появление в высоких концентрациях.
Описание установки.
Потенциостат П-5848 состоит из четырех функционально связанных блоков, работающих совместно с электрохимической ячейкой, КСП и миллиамперметром.
БП-1-25 – блок питания – обеспечивает необходимыми постоянными и переменными напряжениями блоки БНЗ и БУ. На панели этого блока расположен тумблер «Сеть» и кнопка включения «60 – А и Б».
БУ – блок усиления
1. Переключатель
| Ячейка откл. | / | Ячейка вкл. | - | в положении ячейка откл. |
2. Переключатель - «род работы» - «потенциал-ток» - указывает на режим работы.
3. Тумблеры mА1, mА2 с соответствующими клеммами для подключения внешнего миллиамперметра: включен – верхнее положение
отключен – нижнее положение
4. переключатель «+ - » используется для перемены полюсности в случае отклонения стрелки внешнего миллиамперметра влево.
5. Переключатели «диапазон тока, mА» и «множитель тока, mА/V» используются в зависимости от выбора режима работы.
БЗН – блок задающих напряжений
Левая сторона панели БНЗ – система развертки.
| Тумблеры | Уст.0 | Используются при работе в режимах потенциодинамическом и гальванодинамическом с регистрацией на КСП |
| - | ||
| 0 | ||
| Подъем | ||
| Сброс |
По шкале mА на блоке БЗН наблюдают развертку тока.
Переключатели «множитель скорости» и «амплитуда» используются при расчете скорости развертки.
На правой стороне панели БНЗ
Переключатель U1 (U2) с соответствующими задатчиками диапазонов напряжения (1V; 0,1V; mV), с помощью которых выставляются значения начальных и конечных задающих напряжений.
Обратить внимание на положение тумблеров “+ -”, расположенных около задатчиков напряжений U1 (U2), которые указывают на знак рабочего электрода.
БВВ – блок высокоомного вольтметра
1. Тумблер «Сеть»
2. Переключатель U3 Uраб. Uвн - в положении Uраб.
3. Переключатель “+ 0 -” – показывает на полюсность рабочего электрода
4. mА – по шкале mА наблюдают величину, знак и развертку потенциала
5. крайний правый переключатель – положение этого переключателя указывает на выбранную шкалу прибора.
6. Переключатели 1V и 0,1V не используются и находятся в положении “0”.
На правой боковой панели потенциостата находятся:
1. Тумблер «потенциал-ток» - указывает на режим работы
2. Клеммы для подключения ячейки к потенциостату
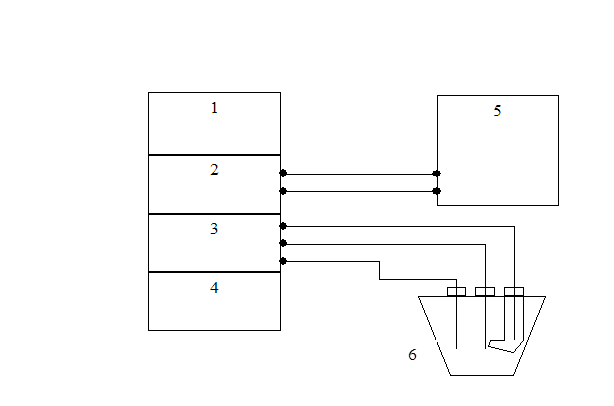
Схема подключения ячейки к потенциостату.
1. БП-1-25 – блок питания
2. БУ – блок усиления
3. БЗН – блок задающих напряжений
4. БВВ – блок высокоомного вольтметра
5. КСП – контрольно-самопишущий потенциометр.
6. Ячейка
исследуемые вещества.
В работе исследовали растворы, содержащие веретенное масло, ПАВ «Брулин», скипидар, K2Cr2O7. Так же исследовали нержавеющую сталь в качестве катода и ОРТА.
Окисно-рутениевый титановый анод (ОРТА)
Окисно-рутениевые титановые аноды получили широкое распространение в промышленности. Роль инертной основы в них играет титан, а активное покрытие состоит из смеси оксидов рутения и титана. Оксид рутения, входящий в состав композиции, обладает металлической проводимостью и достаточно высокой электрохимической активностью Оксид титана полупроводник n-типа, обладающий высокой коррозионной стойкостью. Свойства ОРТА зависят от соотношения оксидов рутения и титана в смеси. Оптимальным с точки зрения электрохимических и электрофизических свойств признано соотношение RuO2:ТiO2 и равное 30:70 мол.%. Изменение содержания RuO2 в активном слое приводит к изменению потенциала ОРТА, что связано с ростом омического сопротивления активного слоя, а изменение сопротивления на границе между титаном и активным слоем с уменьшением содержания RuO2 в активной массе.
ОРТА обычно получают путем термической обработки смеси хлоридов рутения и титана, нанесенной на титановую основу. Операцию повторяют многократно, получая покрытие необходимой толщины. Можно получать ОРТА путем гальванического осаждения рутения на основу с последующей пропиткой пористого покрытия солями титана и термической обработкой при температуре 580-600°С. Пленка, полученная таким образом представляет собой метастабильные дефектные с неполной степенью кристалличности твердые растворы состава RuхТi1-хО2.
Перенос носителей заряда в пленках является электронным процессом, обеспечивающим высокие скорости анодной реакции. ОРТА имеет критический потенциал для электролиза водных растворов хлорида, равный 1,45-1,5 В, выше которого происходит окисление RuO2 до RuO4, сопровождающиеся разрушением композиционной пленки. Потенциал ОРТА при высоких плотностях тока возрастает вследствие окисления не только активной компоненты композиции, но и титановой основы, которая на границе с активным слоем, покрывается смесью оксидов, обладающих запорными свойствами.
В некоторых случаях критических потенциал сдвинут в сторону более чем 1,5 В положительных значений.
Толщина композиционного слоя на поверхности титановой основы в несколько мкм обеспечивает эксплуатацию ОРТА на протяжении 4-6 лет. Титановая основа может быть повторно использована для нанесения композиций из RuO2×и ТiO2. Наиболее удобен способ ремонта ОРТА после окончания тура работы, предусматривающий нанесение нового активного слоя без полного удаления остатков старого[28].
Опыт проводился в потенциодинамическом режиме.
катод из нержавеющей стали.
Молекулярная масса – 91,873
Сталь – сплав железа с углеродом, светло-серый или серый с плотностью 5,3 г/см3. Проводит тепло и электрический ток.
Веретенное масло.
Представляет собой темную маслянистую жидкость. Плотность при 20оС не менее 0,886 – 0,896 г/л.
Температура вспышки не ниже 155оС.
Температура самовоспламенения 280оС.
ПАВ – «Брулин».
Неионоактивное ПАВ. Представляет собой зелено-синюю темную жидкость, растворимую в воде. Разрушает жиры и подтравливает основу металла (удаляет оксидную поверхностную пленку). Биологически разлагаемое вещество. Разработано галандско-русской фирмой «ЭСТОС»
электрод сравнения.
Хлорсеребряный электрод сравнения. Электрод состоит из серебряной пластинки или проволочки, впаянной в стеклянную трубку. На серебро наносят слой хлорида серебра. Способы нанесения соли различны. Осадок на поверхности металла можно получить, например, электролизом, если электролиз вести в растворе соляной кислоты, и серебряную проволочку (или пластинку) подключить к аноду. Катодом может быть платиновый электрод. Благодаря малой растворимости хлорида серебра небольшого слоя соли достаточно, чтобы раствор, содержащий ионы хлора, в который затем опускают электрод, был бы насыщен хлоридом.
методика проведения опыта.
потенциодинамический режим.
Работа с потенциостатом при использовании развертки потенциала проводится в следующем порядке:
1. Перед началом работы необходимо посчитать и выставить скорость развертки потенциала, диапазон тока, скорость движения диаграммной ленты.
2. Проверить включение потенциостата.
| Блок БП – тумблер «сеть» | В верхнем положении |
| Блок БВВ – тумблер «сеть» |
| Блок БВВ – тумблер «анод» | В верхнем положении |
| Блок БП – кнопка «60 – А и Б» | Нажата |
3. На блоке БУ
· Переключатель
| Ячейка откл. | / | Ячейка вкл. | - | в положении ячейка откл. |
· Переключатель «род работы» - в положении «ток», а на правой боковой панели потенциостата тумблер «ток-потенциал» - в положении «ток»
· К клеммам mA1 подключен внешний миллиамперметр, тумблер – в верхнем положении, шкала прибора на mА устанавливается в положении 7,5 А с постепенным повышением чувствительности шкалы прибора в процессе работы.
· Переключатель «множитель тока» - не используется и находится в крайнем правом положении.
4. Скорость развертки потенциала равна произведению значения «амплитуды» на «множитель скорости» (блок БЗН).
5. Скорость движения диаграммной ленты указана в работе и выставляется на КСП.
6. Диапазон тока выставляется для каждой задачи конкретно (блок БУ).
7. На блоке БНЗ:
|
Уст.0 работа |
- в положении «работа» | |
| + | устанавливается в положении «+», если снимается | |
| 0 | анодная поляризационная кривая; «-» - если снимется | |
| - | катодная поляризационная кривая | |
|
подъем сброс |
- в положении «сброс» |
8. Подключить ячейку.
9. По шкале mА на блоке БВВ определяем знак и начальное значение ЭДС (система рабочий электрод – электрод сравнения), с которого будет начат эксперимент. Обратить внимание на положение «шкала прибора», V (крайний правый переключатель).
10. Переключатель напряжений установить в положение U2 (блок БНЗ). Выставить с помощью переключателей задатчиков напряжений U2 величину значения ЭДС (система рабочий электрод – электрод сравнения). Величина начального напряжения выставляется тремя задатчиками напряжения в диапазонах 1V; 0,1V; mV. Численное значение ЭДС получается сложением всех трех величин.
11. Подать напряжение на ячейку, для чего переключатель «род работы» на блоке БУ установить в положение «ячейка вкл.».
12. На блоке БЗН включить тумблер «подъем-сброс» в полложение «подъем». Должны наблюдать развертку тока. На внешнем миллиамперметре, подключенном к клеммам mА1 (mА2) на блоке БУ.
13. Развертку потенциала должны наблюдать на миллиамперметре (блок БВВ).
14. По окончании работы необходимо произвести выключение потенциостата в следующем порядке:
· тумблер «подъем / сброс» в положении «сброс»
· переключатель на блоке БУ
| Ячейка откл. | / | Ячейка вкл. | - | в положении ячейка откл. |
· выключить тумблер движения диаграммной ленты на КСП.
Снимаются кривые, для получения характеристик, в частности, величины перенапряжения при выделении газа на катоде и аноде. Из полученных экспериментальных данных проводится расчет энергетических и тепловых затрат.
результаты снятия вольт-амперных характеристик.
1. Анод. Электролит Na2SO4 2г/л
2. Катод. Электролит Na2SO4 2г/л
3. Анод. Электролит Na2SO4 2г/л + 0,05 мл масла
4. Анод. Электролит Na2SO4 2г/л + замасливание анода 0,1 мл масла в 10 мл ССl4.
5. Анод. Электролит Na2SO4 2г/л + замасливание анода 0,2 мл масла в 10 мл ССl4.
6. Анод. Электролит Na2SO4 2г/л + замасливание анода 1 мл масла в 10 мл ССl4.
1. Анод. Электролит Na2SO4 2г/л + 0,1 мл ПАВ
2. Анод. Электролит Na2SO4 2г/л + 0,15 мл ПАВ
3. Анод. Электролит Na2SO4 2г/л + 0,5 мл ПАВ
4. Анод. Электролит Na2SO4 2г/л + 1,5 мл ПАВ
5. Анод. Электролит Na2SO4 2г/л + 3 мл ПАВ
6. Катод. Электролит Na2SO4 2г/л + 3 мл ПАВ
7. Анод. Электролит Na2SO4 2г/л + 0,01 мл скипидара
8. Анод. Электролит Na2SO4 2г/л + 0,01 мл скипидара + 0,05мл масла + 3мл ПАВ
9. Анод. Электролит Na2SO4 2г/л + 0,01 мл скипидара + 0,05мл масла + 3мл ПАВ + K2Cr2O7 2 мг/л
Растворы выбирались с учетом компонентов, присутствующих в сточных водах данного машиностроительного предприятия. Сточные воды содержат маслосодержащие компоненты, ПАВ из ванн промывки, скипидар и масло из камеры окраски, K2Cr2O7 из гальванического цеха хроматирования. Так же они были выбраны с максимально приближенными концентрациями, соответствующими концентрациям веществ, находящихся в сточной воде предприятия. В модельных растворах присутствуют компоненты, содержащиеся в сточной воде.
Обсуждение результатов.
За эталон был принят раствор электролита, не содержащий примесей. Как видно из кривых 1 и 2 анодная и катодная поляризация мало отличаются друг от друга, к тому же при электрофлотации с нерастворимыми электродами наиболее важен анодный процесс выделения кислорода, а катодный является только усиливающим, поэтому в дальнейшем мы будем рассматривать только анодные кривые. Кривая 3 (с полностью растворенным маслом) так же не сильно отличается от эталона. При замасливании электродов (кривые 4, 5 и 6) перенапряжение на электроде увеличивается и качество очистки резко уменьшается с повышением замасливания и степень очистки уменьшается, но при добавлении ПАВ (кривые 1., 2., 3., 4. и 5.) эффективность увеличивается, т.к. ПАВ предотвращает замасливание, и степень очистки так же увеличивается. Присутствие растворителя (кривая 7) ухудшает процесс очистки, по сравнению с эталонной кривой, однако как видно на кривой 8, перенапряжение на аноде при совместном присутствии всех, рассматриваемых ранее, компонентов степень очистки достаточно высокая. Как видно из кривой 9, присутствие хрома в сточной воде не вызывается большой степени перенапряжения, и степень очистки при совместном присутствии компонентов достаточно высока.
расчет основного оборудования и основных операций.
Расчет электрофлотатора.
Материальные потоки в электрофлотаторе.
Исходные данные:
I = 50 А - токовая нагрузка на аппарат;
tоэл=25оС – температура электролита;
Вт=98%;
Расстояние между электродами 5 – 10 мм
Экспериментальные данные по составу воды, поступающей в аппарат:
Na2SO4=2000 мг/л, Скипидар=0,01 мг/л, Масло веретенное=5 мг/л, ПАВ «Брулин»=30 мг/л, K2Cr2O7 =0,02 мг/л
рН=8,5
Катодные реакции
H2O→H2 + ОН- - 2ē
Анодные реакции
2H2O→O2+4H++4ē
Определение расхода воды при электрофлотации, GH2O
![]()
где GH2O кг/ч - количество воды, вступившее в электрохимическую реакцию на электроде;
Вт - выход по току, доли единицы;
М = 18 - молекулярная масса воды;
26.8 - количество электричества, равная 1 Р, А-ч;
n = 4, 2 соответственно - количество электронов, участвующих в электрохимической реакции.
G1H2O = 0,0082 кг/ч - количество воды, вступившее в реакцию на аноде.
G2H2O = 0,0165 кг/ч - количество воды, вступившее в реакцию на катоде.
GH2O = G1H2O + G2H2O
GH2O = 0,0247 кг/ч
Определение количества образовавшихся газов
![]()
где ![]() кг/ч- количество
образовавшегося водорода,
кг/ч- количество
образовавшегося водорода,
МН2 = 2 - молекулярная масса водорода;
n = 2 - количество электронов, участвующих в электрохимической реакции.
![]() = 0,0019 кг/ч
= 0,0019 кг/ч
![]()
где ![]() кг/ч- количество
образовавшегося кислорода,
кг/ч- количество
образовавшегося кислорода,
МO2 = 32 - молекулярная масса кислорода.
![]() = 0,2195 кг/ч
= 0,2195 кг/ч
Определение количества растворителя (воды), уносимого с газообразными продуктами
а) Определение количества растворителя, уносимого с водородом
![]()
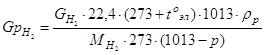
где t0эл = 25 - температура электролита, °С;
22,4 л - объем одного г-моль газа при нормальных условиях;
р = 23,76 мм. рт. ст. = 23,76133 = 3167,2 Па = 31,672 - упругость водяного пара при температуре электролита, гПа;
ρр = 0,02304 - плотность паров растворителя при t0эл, г/л.
![]() = 5,5246 10-4 кг/ч
= 5,5246 10-4 кг/ч
б) Определение количества растворителя, уносимого с кислородом
![]()
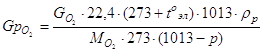
где ![]() - количество
образовавшегося кислорода, кг/ч.
- количество
образовавшегося кислорода, кг/ч.
![]() = 2,7623 10-4 кг/ч
= 2,7623 10-4 кг/ч
Таким образом суммарный расход воды на электролиз:
![]()
![]() =0,0503 кг/ч
=0,0503 кг/ч
Энергетический баланс электрофлотатора.
Общая формула для расчета напряжения на электрофлотаторе:
(Еа - Ек) + (hа - hк) + DЕконц + DЕдиф + DUэл + DUд + DU1 + DUк ,
где U – напряжение на ячейке электролизера, В
Еа, Ек – термодинамические (обратимые) значения потенциалов анода и катода, В
Еа - Ек = Ет – теоретическое напряжение разложения, В
hа, hк – перенапряжение реакций на аноде и катоде, В
DЕконц – величины концентрационной поляризации на аноде и катоде , В
DЕдиф – диффузионный потенциал между анолитом и католитом (при наличии диафрагмы), В
DUэл – падение напряжения в электролите , В
DUд – падение напряжения в диафрагме, В
DU1 – падение напряжения в электродах и токоподводящих шинах, В
DUк – падение напряжения в контактах, В.
Для данного случая мы исключаем из расчета DЕдиф и DUд в связи с отсутствием диафрагмы. Также мы не рассчитываем DЕконц, так как процесс имеет электрохимическую природу. Величинами DU1 и DUк мы пренебрегаем в связи с малостью их вклада в общую величину напряжения на электрофлотаторе.
Расчет теоретического напряжения разложения, Ет
Расчет проводится по доминирующим реакциям, которые идут с наиболее высокими выходами по току.
на катоде: 2H+ + 2е → H2
на аноде: H2O → 1/2O2+2H+ +2ē
суммарная реакция: H2O → H2 + 1/2О2
В таблице приведены стандартные величины энергии Гиббса (DG0), энтальпии (DН0) и энтропии S° для компонентов и продуктов реакции.
Таблица
|
Вещество |
H2O |
(H+) H2O |
Н2(газ) |
О2(газ) |
|
| Терм. функция |
DG0, кДж/моль |
-237,531 |
0 |
0 |
0 |
|
DН0, кДж/моль |
-286,248 |
0 |
0 |
0 |
|
|
S°, Дж/моль град |
70,040 |
0 |
130,761 |
205,322 |
Теоретическое напряжение разложения реализуется при совершении системой максимально полезной работы. Оно вычисляется из изменения изобарно-изотермического потенциала при протекании реакции.
DG0 = nFЕт = -Амах,
где DG0 – стандартный изобарно-изотермический потенциал электродной реакции (энергия Гиббса),
DG0 = (Dni DG0 i)п – (Dni DG0 i)р,
где DG0 i – энергия Гиббса образования компонентов реакции
ni - стехиометрический коэффициент компонента реакции. Индекс "п" означает продукты реакции; индекс "р" означает реагенты реакции.
Для реакции на катоде:
DG0к = DG0 н2 – 2DG0 Н+,
DG0к = 0 кДж/моль
Величина стандартного потенциала на катоде:
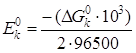 Е0к
= 0
Е0к
= 0
Для реакции на аноде:
В соответствии с правилом термодинамических расчетов, анодную реакцию следует представить в обратном направлении:
1/2O2+2H+ +2ē → H2O. Тогда DG0а = DG0 Н2О – 1/2DG0 О2 – 2DG0 Н+,
DG0а = -237,531 кДж/моль
Величина стандартного потенциала на аноде:
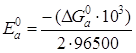 Е0а = 1,231 В
Е0а = 1,231 В
Теоретическое напряжение разложения в стандартных условиях
Е0т = Е0а - Е0к Е0т = 1,231 В
По уравнению Гиббса-Гельмгольца:
Ет = -(DН/nF) + Т(¶Е/¶Т)р,
где ¶Е/¶Т - температурный коэффициент, В/град.
Величина (¶Е/¶Т)р вычислена из следующего уравнения, получающегося из уравнения Гиббса-Гельмгольца:
(¶Е/¶Т)р = DS° /(2×96500), В/град
Вычислим DS°к катодной реакции:
DS°к = DS°Н2 - DS°Н+
DS°к = 130,761 Дж/моль град
Аналогично находим DS°а анодной реакции:
DS°а = DS°Н2О - 1/2DS0О2 - 2DS°Н+
DS°а = -32,621 Дж/моль град
Далее находим DS° суммарной реакции и температурный коэффициент
DS° = DS°а - DS°к DS° = -163,328 Дж/моль град
Ет = 1.231 В
Определение перенапряжения на электродах
Перенапряжение возникает вследствие замедленной одной (или нескольких) стадий переноса заряженных частиц через фазовую границу раздела электрод/раствор и описывается теорией замедленного разряда.
hа = fа – Ет,
где fа = 0,9 В. Величина fа определена из поляризационной кривой по кислороду для ОРТА при плотности тока i = 244,14 А/м2.
hа = 0,46 В
hк = fк – Ет,
где fк = 1,0001 В. Величина fк определена из парциальной поляризационной кривой по водороду для стального электрода при плотности тока
i = 244,14 А/м2.
hк = 0,52 В.
Расчет падения напряжения в электролите
Падение напряжения в электролите может быть рассчитано по закону Ома:
DUэл = I∙Rэл, Rэл = ρ∙(1/S)
где I - ток, проходящий через электрофлотатор, А;
Rэл - сопротивление электролита с учетом газонаполнения, Ом;
ρ - удельное сопротивление электролита с учетом газонаполнения, Ом-м;
l = 0,005 м- расстояние между электродами;
S = 0,02 - м2 площадь поверхности электрода. Поскольку на электродах выделяется некоторое количество газов электролит, содержащий газовые пузырьки имеет большее сопротивление, чем без них. Удельное сопротивление, таким образом, зависит от степени газонаполнения и может быть определено как
Ρ = K∙ρ0
где К – коэффициент, учитывающий увеличение сопротивления электролита из-за наличия в нем газовых пузырьков;
ρ0 - удельное сопротивление электролита без газовых пузырьков, причем
ρ0 = 1/к
где к - удельная электропроводность раствора электролита, Ом-1-м-1.
Таким образом DUэл можно рассчитать по формуле:
DUэл = I∙K∙ρ0∙(1/S)
Величину К определим по формуле:
K = 1/ (1-1,78∙Г+Г2)
где Г = 2 % - газонаполнение электролита, принятое для наших условий.
К =1,036
Величину к определим по формуле:
к = α∙с(λо++λо-)1000
где α = 1 - степень электролитической диссоциации Н2SО4
с = 0,01 г-экв/л - концентрация Н2SО4 (вычислено из значения рН=8,5);
λ=λо++λо-- эквивалентная (молекулярная электропроводность), Ом-1 гэкв-1 м2;
λо+ = 0,03368 Ом-1 гэкв-1 м2 - электролитическая подвижность ионов водорода.
На общий коэффициент электропроводности влияет наличие в электролите солей. Принимаем солесодержание раствора 440 мг/л в пересчете на К2SО4. Концентрация СК2SО4 = 0,005 г-экв/л.
λо- = 0,02203 Ом-1 гэкв-1 м2 - электролитическая подвижность ионов SО42-. Таким образом
к = 0,557 Ом-1 м-1
ρ0 =1,795 Ом м
DUэл = I∙K∙ρ0∙(1/S)
DUэл = 2,269 В
Таким образом общее напряжение на электрофлотаторе
U = ET+(ηа – ηк)+ DUэл
U = 3,715 В
Таблица
Баланс напряжений на электрофлотаторе
| Напряжение на клеммах электрофлотатора, В | Составляющие баланса, В | Доля составляющей, % | |
|
Определенное экспериментально 4.09 |
ET |
1,231 | 33,14 |
|
ηа |
0,704 | 18,95 | |
|
ηк |
0,489 | -13,16 | |
|
DUэл |
2,269 | 61,08 | |
Расчет расхода электроэнергии на электрофлотацию
Расход электроэнергии постоянного тока на одну тонну получаемого продукта производится по уравнению:
Wп = U∙I∙(1/Vэл)
где Wп - расход электроэнергии постоянного тока, кВт-ч/м3;
I - токовая нагрузка на электрофлотатор. А;
U - напряжение на электрофлотаторе, В.
Wп = 3,715 кВт-ч/м3
[29]
оборотная вода
КАМЕРА ОКРАСКИ ДВУХСЕКЦИОННАЯ.
Состоит из корпуса камеры, 2х гидрофильтров с вытяжными вентиляторами и центробежными насосами и двумя подъемными кабинами (поз.10).
Гидрофильтр служит для отсасывания воздуха, в котором находится во взвешенном состоянии окрасочная пыль. Работа гидрофильтра заключается в следующем: воздух из рабочей камеры проходит в гидрофильтре через две водяные завесы, создаваемые переливными лотками, увлажняясь, воздух освобождается от окрасочной пыли, проходит через влагоотделитель (поз.8) который предохраняет воздуховод и вентилятор от попадания влаги и выбросов в атмосферу.
Циркуляцию воды в гидрофильтре обеспечивает центробежный насос (поз.2), приводимый во вращение электродвигателем (поз.1). Вода из нижнего бака (поз.13) через вентиль (поз.4.1) подается в распределительные трубы (поз.14) через запорные вентили (поз.3.1, 3.2) верхняя труба служит для заполнения верхнего бака (поз.15) из которой вода, стекая по щиту (поз.16) образует водяную завесу 1ой ступени гидрофильтра. Нижняя распределительная труба с щитами (поз.17) образует водяную завесу 2ой ступени гидрофильтра. Вентиль (поз.6.1) служит для промывки нижней распределительной трубы. Для смены воды, очистки от грязи и осадков, для предупреждения переполнения бака служит система труб слива и перелива (поз.18) с вентилем (поз.5.1)
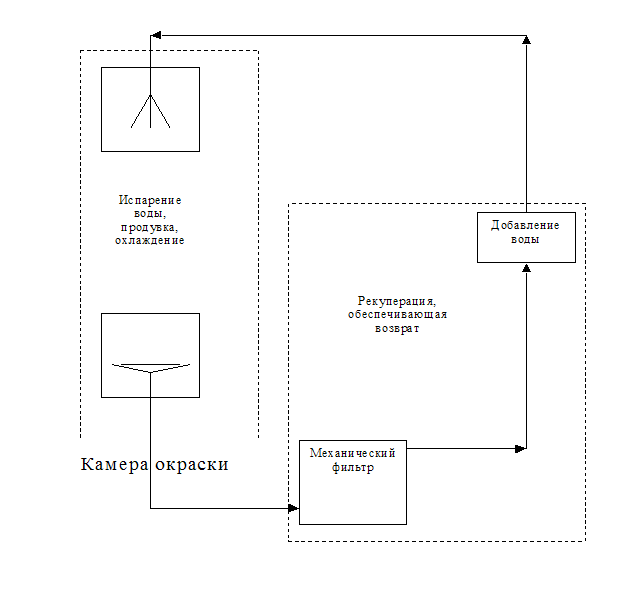
Для обеспечения эффективной работы водяной завесы, после того, как вода попадает в переливной лоток, она проходит рекуперацию, обеспечивающую возврат воды в рабочую камеру водяной завесы. По трубопроводу направляется в механический фильтр. Затем добавляется чистая вода. После чего направляется в камеру завесы. При работе камеры вода насыщается мелкодисперсными частицами краски и растворителя. Не исключено и попадание крупнодисперсных частиц. При распылении и продувке вода испаряется и охлаждается. Затем загрязненная вода собирается в переливном лотке.
Изменение состава воды.
1. Физический процесс – испарение воды.
2. Сорбция компонентов растворителя и органических компонентов краски.
3. Не исключено так же механическое попадание красящих компонентов в занавес.
Необходимо добавление воды, регенерация, оценка повторного испарения воды. Реальное число оборотных циклов будет определено в период опытной эксплуатации.
Расчет оборотна воды в камере окраски.
Данные для расчета:
V= 3м3 - объем камеры водяной завесы;
С0=1,5 г/л – начальная концентрация не выпадающих в осадок растворенных в воде солей;
Сц=15 ;20 г/л – концентрация солей в циркуляционной воде;
Qоб=0,1м3/ч – количество воды, находящейся в обороте;
Сд=С0 – концентрация солей в добавляемой воде;
Расчет производится для нормальных условий (20оС, 760 мм рт. ст.)
Расчет величины испарения и количества добавляемой воды
Сц=С0+![]()
qд – количество добавляемой в систему воды, компенсирующее испарение
t – время работы системы
![]()
![]()
Ку – коэффициент (степень) упаривания
р1 – величина испарения воды в оборотной системе, выраженная в долях от общего количества воды, находящегося в обороте.
1) Расчет величины испарения и количества добавляемой воды для концентрации циркуляционной воды Сц=15 г/л
Ку=10
![]() л/ч
л/ч
![]()
2) Расчет величины испарения и количества добавляемой воды для концентрации циркуляционной воды Сц=20 г/л
Ку=13,33
![]() л/ч
л/ч
![]()
Расчет продувки системы
![]()
рпр – величина продувки [%]
![]()
qпр – количество воды, выводимое из системы продувкой (унос и продувка).
1) Определение величины продувки системы для концентрации циркуляционной воды Сц=15 г/л
![]()
![]() м3/ч
м3/ч
2) Определение величины продувки системы для концентрации циркуляционной воды Сц=20 г/л
![]()
![]() м3/ч
м3/ч
[30].
выводы.
1. Проанализированы технологические процессы нанесения гальванических покрытий и окраски деталей с точки зрения образования жидких отходов и воздействия на окружающую среду.
2. Обоснована схема обезвреживания и очистки гальванического производства с финишной обработкой на электрофлотаторе, обеспечивающем обработку до ПДС.
3. Выполнен поверочный расчет электрофлотатора с токовой нагрузкой 50 А/ч и определены расходы энергии на обработку 1 куб.м воды.
4. Проведено экспериментальное определение вольт-амперных кривых и получены необходимые данные для расчета энергетического баланса электрофлотатора. Проведена оценка влияния присутствия компонентов на электрохимические показатели работы электрофлотатора.
5. Предложена оборотная система использования воды на участке покраски деталей кондиционеров. Рассчитаны основные показатели работы схемы.
6. Показано, что внесенные изменения (предложенная схема очистки оборотной воды и сточных вод гальванического производства электрофлотацией) позволяют обеспечивать рациональное использование воды и уменьшить объем жидких отходов и ущерб наносимый окружающей среде.
Основные понятия и определения.
рН – характеристика среды – -lg н a
а – активность а=сγ
γ – коэффициент активности водорода
Для слабых кислот и оснований рн = -lg н с
рН = 7 – нейтральная среда
Шлам – твердый осадок в технологическом растворе.
Технологический раствор – сточный раствор, в котором протекает процесс.
Нейтрализация – процесс взаимодействия кислоты с щелочью. (экол.) – сведение более ядовитых веществ к менее ядовитым. Т.к. образуется нейтральная среда.
Обезжиривание – стандартный процесс, заключающийся в обработке поверхности растворяющими веществами (органическими или неорганическими), включающими в себя пав (поверхностно-активные вещества) такие как ацетон, ссl4. Чаще используются органические растворители.
Коррозия – окислительно-востановительный процесс разрушения металла.
Химическая коррозия – протекает в среде неэлектролита при высоких температурах.
Электрохимическая коррозия – протекает в среде электролита при обычной температуре.
Ме0- ne→ ме+nе δg‹0
Окисленная форма более устойчивая.
Коагуляция – процесс потери агрегативной устойчивости коллоидной системы. Процесс слипания частиц.
Агрегативная устойчивость – условие существования коллоидной системы.
Коллоидная система – содержит дисперсную фазу и дисперсионную среду. Состоит из агрегативных молекул (слипшихся). Отличается размером частиц дисперсной фазы.
Адгезия – процесс прилипания частиц к поверхности твердой фазы.
Травление – процесс обработки поверхности металла, заключающийся в изменении свойств поверхности металла.
Декапирование - легкое травление для подготовки поверхности к нанесению покрытия, обновление поверхности. Выявление структуры поверхности.
Аэрозоли – коллоидная система дисперсионная среда – газ, дисперсная фаза – жидкость.
Флотация – очистка сточной воды. Процесс, при котором через загрязненную воду пропускают воздух, который захватывает твердые частицы и поднимает их наверх.
Электрофлотация – с помощью электрического тока (постоянного) заряженные частицы отделяются от воды.
Литература.
1. Яковлев С.В. Перспективы развития и совершенствования водного хозяйства машиностроительных предприятий //Очистка производственных сточных вод и утилизация осадков машиностроительной промышленности. Матер. семин. – М., 1988. – С.3-8.
2. Шалкаускас М. Проблема отходов гальванотехники. //Материалы семинара «Малоотходные ресурсосберегающие процессы в гальванотехнике». – М. МДНТП. 1988 С.3-6.
3. Гарбер М.И. Ресурсосберегающая технология гальванического производства. //Там же.,С.7-13.
4. Технология и оборудование для очистки и обезвреживания сточных вод и газовых выбросов гальванических производств: Каталог/ВИМИ. – 1992. 1-112с., ил.
5. Панасенко С.А., Гужва И.И., Марк П.И. и др. Замена токсичного шестивалентного хрома на трехвалентный в хроматирующих растворах. //Тез. докл. к совещанию «Совершенствование технологии гальванических покрытий», Киров, 1989, С.37.
6. Пащенко Э.Н., Журавлев В.П., Гресова В.И., Можаровская Г.С. Очистка сточных вод от шестивалентного хрома методом восстановления. / Всес. н.-и. и консрукт.-технол. ин-т труб. пром-ти. – Днепроетровск, 1988. Деп.ВИНИТИ №4760-88, -12 с.
7. Бучило Э. Очистка сточных вод травильных и гальванических отделений. М., Металлургия, 1974, 200 с.
8. Колесников В.А. Экология и ресурсосбережение электрохимических производств. Учебное пособие по курсу «Основы электрохимической технологии». М., МХТИ, 1989, - 68 с.
9. Запольский А.К., Баран А.А. Коагулянты и флокуллиты в процессах очистки воды: Свойства. Получение. Применение. – П.: Химия, 1987. – 208 с.
10. Велинская В.С. Состояние и перспективы развития очистки сточных вод электрохимическими методами //Отчет о научно-исследовательской работе. ВНИИГПЭ, М., 1В.251, № гос. регистрации 81050158, 1985.
11. Селицкий Г.А. Электрокоагуляционный метод очистки сточных вод от ионов тяжелых металлов. – М., 1978, - 24 с. – (Охрана окружающей среды: Обзор. информ. //ЦНИИцветмет экономики и информации; Вып.2)
12. Бунин Н.И. Электрофлотокоагуляционные установки для очистки сточных вод предприятий АПК //Междунар. агропром. ж. – 1989. – № 6. – с. 125-130.
13. Мамаков А.А. Разделение жидких неоднородных систем электролитической флотацией //Электронная обработка материалов. – 1977. - №5. – с. 41-49.
14. Морозов А.Ф., Глебов Ю.М., Морозова В.П. Электрофлотационный аппарат для очистки сточных вод от взвесей. //Электронная обработка материалов. – 1986. - №1. – с. 57-59.
15. Матов Б.М. Электрофлотационная очистка сточных вод. – Кишинев: Картя Малдовеняскэ, 1982. – 170 с.
16. Амирханова Н.А., Шарипова Л.П., Шарипова С.Н., Саянова В.В. Регенерация Cr (VI) в ваннах электрохимических станков. //Экологические проблемы в области гальванотехники. Тез. докл. Межреспубл. научно-техн. конф. 22-26 апр. 1991. Киев.1991.
17. Чикин Г.А., Мягкой О.Н. Ионообменные методы очистки веществ. Воронеж. Изд-во БГУ, 1984, 870с.
18. Гарбер Ю.М. О механизме сорбции хроматов анионитом АБ-17. // Ж. неорг. химия. т.30 №8 1985. с. 2163-2165.
19. Салдадзе Г.К., Кариман Л.П., Барсукова Н.В. и др. Разработка сорбционной технологии селективного извлечения хрома (VI) из кислых промывных вод ГПЗ-2 с оборотом очищенной воды. //Подшипниковая промышленность передовой производственный опыт, рекомендуемый для внедрения. – 1991, №2, с. 29-34.
20. Колесников В.А., Кокарев Г.А., Вараксин С.О. и др. Электрофлотация с нерастворимыми анодами в процессах водоочистки и регенерации ценных компонентов из жидких стоков. //ХIV Менделеевский съезд по общей и прикладной химии. Рефераты докл. и сообщ. №2, М.: «Наука», 1989, с. 438.
21. Колесников В.А., Вараксин С.О., Громова Е.В. Некоторые закономерности электрофлотационного извлечения ионов никеля, меди, цинка из промывных и сточных вод гальванических производств. // Сбор. науч. трудов МХТИ. Очистка сточных вод и регенерация ценных компонентов, м.: 1990, с. 12-124.
22. Колесников В.А., Ааринола П.К. Очитска сточных вод оксидов никеля в цехах гальванического производства методом электрофлотации. //Гальванические покрытия для товаров народного потребления. Матер. науч. семинара. 14-15 апр. 1992. С-Петербург.
23. Запольский А.К., Образцов В.В. Комплексная переработка сточных вод гальванического производства. – М. МДНТП. 1988
24. Бучило, Очистка сточных вод гальванического производства.
25. Родионов А.И., Кузнецов Ю.П., Зенков В.В., Соловьев Г.С. Оборудования, сооружения, основы проектирования химико-технологических процессов защиты биосферы от промышленных выбросов. Учебное пособие для ВУЗов. – М., Химия, 1985. – 352 с.
26. Виноградов С.С. Экологически безопасное гальваническое производство. Прилож. к журналу «Гальванотехника и обработка поверхности», М. «Глобус», 1998г. – 302 с.
27. Колесников В.А., Вараксин С.О., Громова Е.В. Некоторые закономерности электрофлотационного извлечения ионов никеля, меди, цинка из промывных и сточных вод гальванических производств // Сбор. науч. трудов МХТИ. Очистка сточных вод и регенерация ценных компонентов, М.: 1990, с. 120-124.
28. Ротиян А.Л., Тихонов К.И., Шошина И.А. Теоретическая электрохимия. Л. «Химия», 1981г, с. 161-167.
29. Фиошин М.Я., Кокарев Г.А., Новиков В.Т. Методические указания к дипломному проекту. Раздел «Электролиз без выделения металлов», МХТИ, М., 1980, 48с.
30. Белан Ф.И. Сборник задач. М., Химия, 1974г.